Performance evaluation of PANA 9600E automatic nucleic acid extraction platform for ultra-sensitive HBV DNA quantitative detection
-
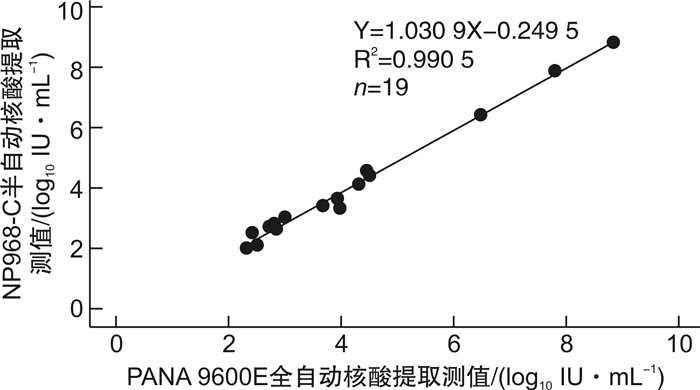
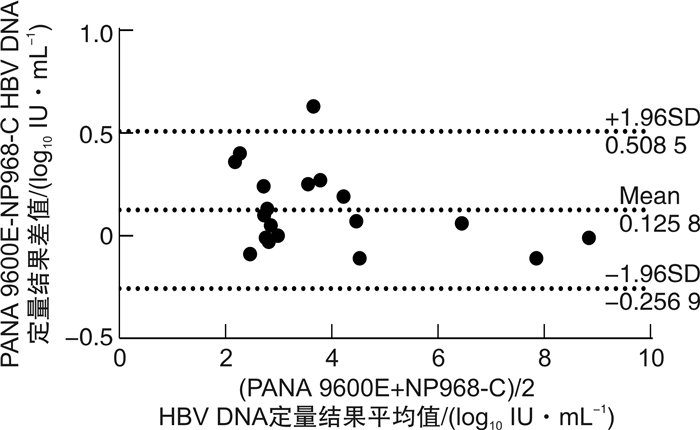
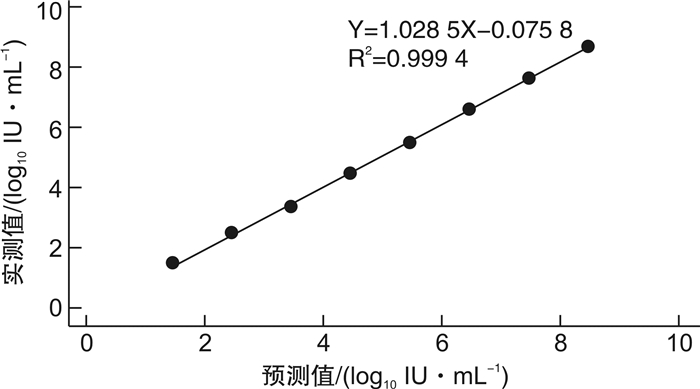
摘要: 目的 对全自动核酸工作站PANA 9600E的超敏HBV DNA定量检测性能进行评价, 评估其是否满足临床应用要求。方法 参考美国临床和实验室标准化协会(CLSI)和中国合格评定国家认可委员会(CNAS)等相关文件, 采用天隆PANA 9600E全自动核酸工作站及其配套HBV DNA超敏定量检测试剂和GENTIER 96E实时荧光定量PCR仪, 应用HBV DNA血清标准物质、临床混合血清样本和乙型肝炎病毒核酸国家标准品, 对该检测系统的正确度、精密度、线性范围、定量限、检出限、防交叉污染、抗干扰能力等性能进行评价;同时与NP968-C半自动系统检测56例临床血清样本进行方法学比对。结果 ① PANA 9600E系统检测HBV DNA血清标准物3个浓度4.60×106、1.41×103和2.00×102 IU/mL的均值与靶值的差值绝对值均小于0.40 log10IU/mL, 正确度满足行业标准;检测2.0×102、2.0×103、2.0×104和2.0×106 IU/mL 4个浓度的临床混合血清样本, 重复性精密度CV分别为3.93%、1.50%、0.89%和0.54%, 中间精密度CV分别为5.00%、1.95%、1.36%和1.35%, 精密度验证通过;②PANA 9600E系统在3.0×101IU/mL~3.0×108IU/mL内呈线性, 线性回归方程为Y=1.028 5X-0.075 8, R2=0.999 4;定量限为30 IU/mL, 检出限为10 IU/mL;防交叉污染验证通过, 阴性样本检测结果均为阴性;当胆红素≤512 μmol/L、血红蛋白≤100 mg/mL、甘油三酯≤18 mmol/L时对该系统的检测结果无明显影响, 抗干扰能力验证通过;③对于56例临床血清样本, PANA 9600E和NP968-C系统检出的阳性率分别为60.71%(34/56)和57.14%(32/56), 差异无统计学意义(P>0.05), Kappa值为0.852 6(95%CI: 0.713 9~0.991 4), 一致性较好;对于定量范围内的19例临床血清样本, PANA 9600E和NP968-C系统的检测值分别为3.954±1.850、3.828±1.916 log10IU/mL, 差异有统计学意义(P< 0.05);进一步进行Pearson相关和Bland-Altman图分析, 回归方程为Y=1.030 9X-0.249 5, R2=0.990 5;2种方法检测结果差值为(0.125 8±0.195 3) log10IU/mL, 95%一致性界限为-0.256 9~0.508 5 log10IU/mL, 94.74%(18/19)的点在95%一致性界限以内, 界外点数为1(5.26%)。结论 基于PANA 9600E全自动核酸工作站的超敏HBV DNA定量检测系统的正确度、精密度、线性范围、定量限、检出限、抗交叉污染、抗干扰能力等性能良好;定量限为30 IU/mL, 检出限为10 IU/mL, 达到超敏检测的要求;与现用的NP968-C半自动系统的检测结果具有可比性, 相关性和一致性好, 可满足临床应用要求。Abstract: Objective To evaluate the performance of PANA 9600E automatic nucleic acid extraction platform for ultra-sensitive HBV DNA quantitative detection and assess whether it meets clinical needs.Methods The clinical mixed serum samples, standard materials for serum HBV DNA and national standard for HBV DNA were employed for performance evaluation. The analytical performance, such as trueness, precision, linearity, limit of quantification(LoQ), limit of detection(LoD), cross-contamination and anti-interference capability, was determined using PANA 9600E automatic ultra-sensitive HBV DNA quantification system. Correlation and Bland-Altman plot analysis were carried out to compare the clinical performance of the automatic PANA 9600E system and the semi-automatic NP968-C system.Results ① The differences between the expected and tested concentrations of these three standard materials for serum HBV DNA measured by PANA 9600E platform using ultra-sensitive HBV DNA quantitative kit were all within 0.4 log10IU/mL, which showed high trueness. The repeatability and intermediate precision(%CV) of the PANA 9600E system were 3.93% and 5.00% at 2.0×102IU/mL, and 1.50% and 1.95% at 2.0×103IU/mL, and 0.89% and 1.36% at 2.0×104IU/mL, and 0.54% and 1.35% at 2.0×106IU/mL, respectively. ②The linearity of this assay ranged from 30 to 3.00×108IU/mL, and the linear regression equation was Y=1.028 5X-0.075 8(R2=0.999 4). The LoQ was 30 IU/mL, and the LoD was 10 IU/mL. There was no cross-contamination during the checkerboard test. No significant interference was found in the test when bilirubin ≤512 μmol/L, hemoglobin ≤100 mg/mL, or triglyceride ≤18 mmol/L. ③The detection rates of 56 clinical serum samples obtained by PANA 9600E and NP968-C systems were 60.71%(34/56) and 57.14%(32/56) respectively(P>0.05). The kappa value between qualitative results was 0.852 6(95%CI: 0.713 9 to 0.991 4). The detection values of HBV DNA load obtained by PANA 9600E and NP968-C systems were 3.954±1.850 and 3.828±1.916 log10IU/mL, respectively(P< 0.05). The correlation analysis indicated a significant correlation between both assays(Y=1.030 9X-0.249 5, R2=0.990 5). The Bland-Altman plot analysis found the mean difference was 0.125 8 log10IU/mL(95%CI: -0.256 9 to 0.508 5); the proportion of the specimens within the 95% limit of agreement was 94.74%(18/19) between both assays.Conclusion The PANA 9600E automatic ultra-sensitive HBV DNA quantification system has good analytic performance with high precision and trueness, good linearity, anti-cross-contamination ability and anti-interference capability, and exhibits good agreement with the semi-automatic NP968-C system in clinical performance, and could meet the clinical needs.
-
Key words:
- HBV DNA /
- quantification /
- performance evaluation /
- comparison
-

-
表 1 PANA 9600E检测系统正确度验证结果
log10IU/mL HBV DNA国家标准物质 检测均值 靶值 差值 GBW(E)090139(S2) 6.34 6.66 -0.32 GBW(E)090137(S5) 3.13 3.15 -0.02 GBW(E)090586(S7) 2.01 2.30 -0.29 表 2 PANA 9600E检测系统精密度验证结果
log10IU/mL 浓度(IU/mL) 重复性精密度 中间精密度 X±S CV/% X±S CV/% 2.0×102 2.27±0.09 3.93 2.18±0.11 5.00 2.0×103 3.21±0.05 1.50 3.19±0.06 1.95 2.0×104 4.16±0.04 0.89 4.23±0.06 1.36 2.0×106 6.12±0.03 0.54 6.32±0.09 1.35 表 3 PANA 9600E系统抗干扰能力验证结果
log10IU/mL,X±S 变量 胆红素(512 μmol/L) 血红蛋白(100 mg/mL) 甘油三酯(18 mmol/L) 3.65 5.71 3.65 5.71 3.65 5.71 对照组 3.66±0.05 5.71±0.09 3.66±0.05 5.71±0.09 3.66±0.05 5.71±0.09 干扰组 3.61±0.01 5.74±0.06 3.60±0.03 5.73±0.01 3.66±0.02 5.67±0.08 偏倚/% -1.38 0.49 -1.83 0.41 0.07 -0.67 -
[1] World Health Organization(WHO). WHO global hepatitis report 2017[EB/OL]. [2021-07-18]. https://www.who.int/hepatitis/publications/global-hepatitis-report2017/en/.
[2] Polaris Observatory Collaborators. Global prevalence, treatment, and prevention of hepatitis B virus infection in 2016: a modelling study[J]. Lancet Gastroenterol Hepatol, 2018, 3(6): 383-403. doi: 10.1016/S2468-1253(18)30056-6
[3] 中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2648-2669. https://www.cnki.com.cn/Article/CJFDTOTAL-LCGD201912010.htm
[4] European Association for the Study of the Liver. Electronic address: easloffice@easloffice. eu, European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection[J]. J Hepatol, 2017, 67(2): 370-398. doi: 10.1016/j.jhep.2017.03.021
[5] Terrault NA, Lok A, McMahon BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67(4): 1560-1599.
[6] Cornberg M, Lok AS, Terrault NA, et al. Guidance for design and endpoints of clinical trials in chronic hepatitis B-Report from the 2019 EASL-AASLD HBV Treatment Endpoints Conference[J]. J Hepatol, 2020, 72(3): 539-557. doi: 10.1016/j.jhep.2019.11.003
[7] 肖圣达, 耿帜, 徐远东, 等. HBV DNA超敏定量检测试剂盒的性能验证[J]. 临床血液学杂志, 2021, 34(2): 81-85. https://www.cnki.com.cn/Article/CJFDTOTAL-LCXZ202102001.htm
[8] Liu Y, Liu H, Hu Z, et al. Hepatitis B Virus Virions Produced Under Nucleos(t)ide Analogue Treatment Are Mainly Not Infectious Because of Irreversible DNA Chain Termination[J]. Hepatology, 2020, 71(2): 463-476. doi: 10.1002/hep.30844
-




 下载:
下载: