Expression of myeloid cell leukemia-1 in diffuse large B cell lymphoma and its clinical significance
-
摘要: 目的 检测髓细胞白血病-1(Mcl-1)在弥漫大B细胞淋巴瘤(DLBCL)中的表达,分析Mcl-1的表达在DLBCL中的临床意义。方法 免疫组织化学染色检测43例DLBCL患者的淋巴结石蜡病理标本的Mcl-1表达,所有患者均接受6~8个疗程R-CHOP方案免疫组织化疗,根据2014版Lugano评效标准,疗效达完全缓解(CR)或部分缓解(PR)且1年内无复发者为初始治疗有效组(26例);疗效为疾病稳定(SD)、疾病进展(PD),或曾达到CR或PR,但在缓解后1年内复发者为初始治疗无效组(17例)。分析Mcl-1表达与DLBCL患者临床特征的相关性以及其在初始治疗有效组和无效组之间是否存在差别。结果 Mcl-1阳性率为58.1%(25/43),其表达与患者性别、年龄、有无B症状等临床特征均无相关性(P>0.05);Mcl-1在初始治疗有效组阳性率为38.5%(10/26),无效组阳性率为88.2%(15/17),两组之间Mcl-1表达差异有统计学意义(P < 0.05)。Mcl-1表达阳性组对初始治疗无效的概率是阴性组的15.625倍,B淋巴细胞瘤-2基因(Bcl-2)的表达作为预测治疗反应因素的假设不成立。Mcl-1和Bcl-2联合预测模型的效果要优于Mcl-1或Bcl-2表达的单独预测模型。结论 Mcl-1阳性与否可作为对初始治疗反应不佳的预测因素,Bcl-2和Mcl-1共表达是DLBCL患者一种理想的独立预后因素。Abstract: Objective To detect the expression of Mcl-1 in diffuse large B cell lymphoma(DLBCL) and analyze the clinical significance of the expression of Mcl-1 in DLBCL.Methods Immunohistochemical staining was used to detect the expression of Mcl-1 in paraffin pathological specimens of lymph nodes of 43 patients with DLBCL. All patients received 6-8 courses of R-CHOP regimen immunochemotherapy. According to the Lugano 2014 criteria, those who achieved CR or PR efficacy and had no relapse within 1 year were defined as the initial treatment effective group(26 cases); Patients with efficacy of SD, PD, or those who had achieved CR or PR, but relapsed within 1 year were defined as the initial treatment ineffective group(17 cases). The correlation between Mcl-1 expression and clinical characteristics of DLBCL patients, as well as whether there was a difference between the treatment effective group and the ineffective group was analyzed.Results The positive rate of Mcl-1 was 58.1%, there was no correlation between the expression of Mcl-1 and the patient's gender, age and the presence or absence of symptoms of B etc(P>0.05). After the initial immunochemotherapy, the positive rate of Mcl-1 was 38.5%(10/26) in the effective group and 88.2%(15/17) in the ineffective group(P < 0.05).The probability that the group of positive Mcl-1 expression had no response to the initial immunochemotherapy was 15.625 times that of the negative group, the hypothesis that Bcl-2 expression was a predictor of therapeutic response was not valid. The effect of the combined prediction model of Mcl-1 and Bcl-2 was better than that of the single prediction model of Mcl-1 or Bcl-2.Conclusion The expression of Mcl-1 could be used as a predictor of DLBCL's no response to initial immunochemotherapy. As an independent factor of poor prognosis, coexpression of Bcl-2 and Mcl-1 could be a rational choice.
-
Key words:
- diffuse large B cell lymphoma /
- Bcl-2 /
- Mcl-1 /
- targeted therapy /
- inhibitors
-
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是一种最常见的侵袭性非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL),约占成人NHL的34%[1],欧洲的发病率约为每年3.8/10万人。大部分DLBCL通常对一线免疫化疗(R-CHOP)方案有较好反应,但由于肿瘤细胞来源的差异性和潜在的遗传驱动因素不同,导致患者对R-CHOP治疗反应也表现为异质性,因此仍有40%的患者表现为复发/难治性DLBCL[2-3]。如何延长复发/难治性DLBCL患者的生存期、改善其预后已经成了国内外的热点研究问题。
B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2),其蛋白家族是一组凋亡/抗凋亡蛋白,在维持组织的稳态、发育,对受损细胞进行及时清除,以及在正常细胞的凋亡调控过程中发挥关键作用。髓细胞白血病-1(Mcl-1)作为抗凋亡蛋白中的关键成员,是人类肿瘤中最常见的扩增染色体区域之一,其过表达通常与肿瘤的发生、对细胞毒药物和靶向治疗耐药性有关。De Jong等[4]用相应的BCL-2家族蛋白抑制剂(BH3类似物)验证细胞特异性抗凋亡依赖性,发现DLBCL的抗凋亡作用通常只依赖于Bcl-2或Mcl-1,且CHOP治疗可以增强并改变对抗凋亡蛋白的依赖(而不一定改变抗凋亡蛋白的表达水平);DLBCL的Bcl-2/MYC双打击SUDHL-10细胞株在CHOP处理前后对Mcl-1抑制剂均展现出明显的抑制作用,而对Bcl-2抑制剂则无明显反应,这为抗R-CHOP的DLBCL的治疗提供了新方向,许多复发难治性DLBCL患者可能将更受益于Mcl-1抑制剂。但现阶段Mcl-1在DLBCL中表达及与临床相关性分析的数据非常有限,因此,本研究拟应用免疫组织化学染色检测Mcl-1在DLBCL中的表达,并利用统计学方法探究Mcl-1表达与DLBCL临床预后的相关性。
1. 资料与方法
1.1 资料
回顾性收集河北医科大学第二医院血液内科2013年1月—2019年1月收入院,以手术切除或者活检获得,经病理科确诊的43例DLBCL患者,患者诊断应满足世界卫生组织(WHO) 2016淋巴瘤的分类标准,同时选同时期手术切除的淋巴增殖性疾病(reactive lymphoproliferative disease,RLD)的石蜡包埋蜡块10例作为对照组。所有病例均为初治患者,且术前无接受放、化疗病史。收集患者相关临床资料,包括年龄、性别、IPI评分、Ann Abor分期、免疫组织化学水平的病理亚型、Ki-67表达、Bcl-2表达、化疗方案、疗效评估及预后转归等。Bcl-2表达(以20%为界限)[5];Ki67表达(以60%表达为界限)[6];患者一线治疗方案首选R-CHOP方案(利妥昔单抗375 mg/m2,d1;环磷酰胺750 mg/m2,d2;脂质体阿霉素30 mg/m2,d2;长春新碱1.4 mg/m2,d2;泼尼松100 mg,d2~6),每21 d重复1个疗程,6~8个疗程后,参考2014版Lugano评效标准。疗效达完全缓解(CR)或部分缓解(PR)且1年内无复发者定义为初始治疗有效组,共26例。疗效为病变稳定(SD)、病变进展(PD)或尽管曾达到CR或PR,但在缓解后1年内复发者定义为对初始治疗效果无效组,共17例。43例DLBCL患者具体临床特征详见表 1。
表 1 43例DLBCL患者临床特征临床特征 例数 百分比/% 性别 男 21 48.8 女 22 51.2 年龄/岁 ≥60 31 72.1 < 60 12 27.9 B症状 是 11 25.6 否 32 74.4 结外受累 是 28 65.1 否 15 34.9 Ann Arbor分期 Ⅰ+Ⅱ 17 39.5 Ⅲ+Ⅳ 26 60.5 IPI积分 低危组(低危+低中危) 22 51.2 高危组(高危+高中危) 21 48.8 分子亚型 GCB 18 41.9 non-GCB 25 58.1 乳酸脱氢酶(LDH) 正常 27 62.8 升高(>250 U/L) 16 37.2 β2-微球蛋白 正常 29 67.4 升高(>2.64 mg/L) 14 32.6 Bcl-2表达 阳性 21 48.8 阴性 22 51.2 Ki67表达 阳性 31 72.1 阴性 12 27.9 初始治疗反应 有效 26 60.5 无效 17 39.5 1.2 试剂与仪器
Mcl-1试剂购买自ARIGO公司,规格:50 μL/支。DAB显色试剂盒、SP免疫组织化学试剂盒(PV-9000)购自北京中杉金桥生物技术有限公司。二抗(免疫显色试剂):Bond Polymer Refine Detection,生产商为Leica Biosystems Newcastle Ltd,原产于英国。试验仪器:Leica BOND-Max全自动免疫组织化学和原位杂交多功能染色仪,生产商:Leica Biosystems Melbourne Pty Ltd,原产国为澳大利亚。
1.3 病理切片免疫组织化学染色
选取实验组及对照组患者由手术摘除的淋巴结病理蜡块。连续切片,厚度约4 μm,展片后迅速捞出,晾干后于在55℃环境中干燥24 h。上述所有切片脱蜡至水,修复液进行组织修复20 min,滴加3%过氧化氢放入室温孵育4 min,反复蒸馏水冲洗,PBS浸泡,消除内源性过氧化物酶的活性及非特异性背景着色。以PBS稀释后的5%~10%正常山羊血清进行封闭,室温孵育10 min,随后倾去血清。PBS缓冲盐水(pH 7.6)稀释的Mcl-1一抗(稀释比例1∶50)室温下进行孵育20 min,再次添加稀释倍数相同的Mcl-1抗体复染10 min,添加二抗孵育10 min,DAB显色10 min后苏木精-伊红复染5 min,最后进行脱水、透明和封片,光学显微镜下进行观察免疫组织化学结果并记录、取像。
PBS替代第一抗体取像作为阴性对照。400倍光学显微镜下连续观察10个视野,每个视野不少于100个细胞,计算1 000个肿瘤细胞阳性细胞数,大于50%的肿瘤细胞阳性定义为强阳性,大于10%的肿瘤细胞阳性定义为Mcl-1阳性,阳性细胞少于10%定义为阴性。
1.4 统计学分析
采用SPSS 23.0统计软件对实验数据进行统计学分析,计数资料采用χ2或连续性校正χ2检验,危险因素的预测能力采用logistic回归方程分析,并绘制受试者工作特征曲线(ROC)曲线比较预测效果。以P < 0.05为差异有统计学意义。
2. 结果
2.1 Mcl-1在DLBCL中的阳性率
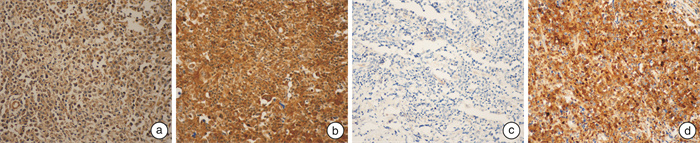
免疫组织化学显示Mcl-1蛋白阳性在病理切片中表现为细胞质内弥漫性的褐色细颗粒染色,少数为核周细胞质的颗粒型染色。Mcl在DLBCL和RLD患者中的示意性免疫组织化学图(图 1)。在43例DLBCL的病理切片中,Mcl-1阳性为25例,阳性率为58.1%(25/43)。其中强阳性为16例,占总数的37.2%,占阳性病例的64.0%。10例RH组织切片中,Mcl-1的阳性表达仅为1例,阳性率为10.0%。DLBCL与RH组织比较,差异有统计学意义(P < 0.05)。
2.2 Mcl-1的表达与临床病理因素的相关性
Mcl-1表达与性别、年龄、有无B症状、淋巴结累及区域、有无结外浸润、Ann分期、IPI积分、分型、Bcl-2表达、LDH水平、β2微球蛋白和Ki67表达均无相关性(P>0.05)。Mcl-1在初始治疗反应分组中的有效组阳性率38.5%,无效组阳性率88.2%,两者进行比较,差异有统计学意义(P=0.001)。
2.3 Mcl-1表达与Bcl-2表达对初始治疗反应的预测
本研究重点探讨了Mcl-1表达对DLBCL初始治疗反应的预测,二分类logistic回归模型分析结果示Mcl-1表达对初始治疗反应的预测[OR=0.064,95%CI(0.001~0.405),P=0.004]。Mcl-1表达阳性组的治疗有效概率是阴性组的0.064倍,即Mcl-1表达阳性组对初始治疗无效的概率是阴性组的15.625倍。
文中同期对比了经典的抗凋亡蛋白Bcl-2表达对DLBCL初始治疗反应的预测,Bcl-2表达对初始治疗效果的预测[OR=0.158,95%CI(0.032~0.784,P>0.05)],Bcl-2的表达作为预测治疗反应的因素假设不成立。所以本研究基于有限的病例数据证明,Mcl-1表达水平可以作为预测DLBCL患者对初始治疗反应的生物学指标,而传统的Bcl-2的蛋白表达水平则不能。
2.4 Mcl-1与Bcl-2同时表达对治疗反应的预测价值
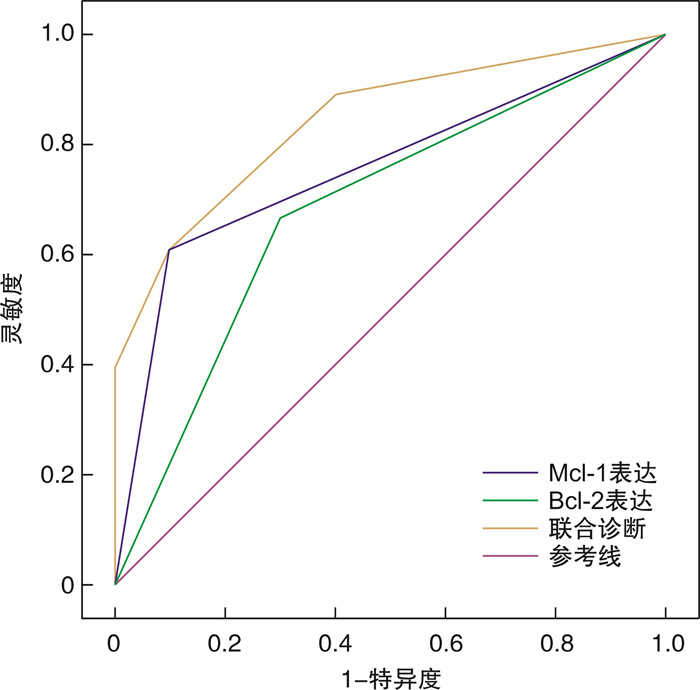
为分析Mcl-1和Bcl-2同时表达对初始治疗反应的预测能力,对Mcl-1、Bcl-2和双表达进行logistic回归建模。并据此绘制ROC曲线,结果显示:双表达的曲线下面积(area under curve,AUC)为0.924(P < 0.05),灵敏度为0.662,特异度为0.927。双表达的AUC大于2个指标单因素预测的AUC,说明联合预测模型的效果要优于Mcl-1表达或Bcl-2表达的单独预测模型见表 2,图 2。
表 2 Mcl-1和Bcl-2双表达曲线下面积检验变量 AUC SE 95%CI 灵敏度 特异度 下限值 上限值 Mcl-1表达 0.687 0.004 0.002 0.452 0.624 0.15 Bcl-1表达 0.612 0.105 0.041 0.814 0.651 0.710 双表达 0.924 0.002 0.014 0.897 0.662 0.927 3. 讨论
DLBCL是一类临床上最常见的侵袭性NHL,在细胞生物学、遗传学、临床表现和疾病转归方面异质性很大。近年来,随着治疗手段不断发展,特别是利妥昔单抗联合CHOP方案的问世,使DLBCL的疗效和长期生存率有了大幅提高,但仍然有一些患者出现复发或难治。因此,在现有治疗手段下,DLBCL仍然是一种不可治愈性的疾病[7],急需为这些患者开发新的治疗方法。
研究表明,淋巴瘤凋亡耐药的发生是导致大部分淋巴瘤患者治疗失败的主要原因,对未来提高淋巴瘤患者生存时间和生活质量新疗法的努力,必须包括针对淋巴瘤细胞对化疗药物的抗凋亡的策略。Bcl-2蛋白家族的抗凋亡蛋白表达失调造成的肿瘤细胞凋亡逃逸,是肿瘤发展的一个关键因素,也是化疗中耐药性形成、导致治疗失败的主要原因之一。作为抗凋亡蛋白中的主要分子,Mcl-1是人类癌症中最常见的扩增染色体区域之一,在多种B-NHL[8-11]中均有表达,且与耐药性的形成密切相关,提示Mcl-1极有可能为未来临床中B-NHL的治疗提供一个关键的新靶点及更佳的治疗方案。大量证据支持Mcl-1是一个有吸引力的研究方向,但相比于Bcl-2,Mcl-1的表达以及其分子抑制剂的研究进展相对缓慢,并且Mcl-1在DLBCL中表达及与临床相关性的分析数据非常有限,本研究回顾性分析了我院单中心经病理确诊的43例DLBCL患者的临床特征,并应用免疫组织化学染色方法检测了这些患者淋巴结石蜡包埋组织中Mcl-1的表达水平,运用相关统计学方法进一步明确Mcl-1的表达与DLBCL临床分期、病理亚型和治疗反应等方面的相关性,为未来Mcl-1抑制剂在DLBCL的研究提供理论依据。
本研究结果显示,Mcl-1的阳性表达率为58.1%,结合相关文献,DLBCL病理组织的Mcl-1的阳性表达率为64.7%(11/17)[10],本研究结果与该文献基本一致。在De Jong等[4]的研究中,DLBCL细胞的Mcl-1阳性率为95%,抗凋亡依赖为Bcl-2或者Mcl-1,并且相比于其他细胞系,SUDHL-5和SUDHL-10细胞系依赖于Mcl-1的抗凋亡功能更明显。作为抗凋亡分子中的关键成员,Mcl-1在血液肿瘤(如慢性髓系白血病、多发性骨髓瘤、急性髓系白血病[12-15]、非霍奇金淋巴瘤[8, 16-18])及多个系统实体肿瘤(如乳腺癌[19]、肝癌[20]、非小细胞肺癌[21])等中均呈过表达状态,并通常与疾病的恶性程度高以及短生存期相关。此外,Mcl-1还驱动对化疗药物和其他靶向抗凋亡药物耐药性的形成。
本研究中,Mcl-1在DLBCL中的表达与性别、年龄、疾病分型、有无B症状、有无结外浸润、Ann Arbor分期、IPI积分、病理分型、Bcl-2表达、LDH水平、β2微球蛋白水平、Ki67表达等均无相关性,这可能与本研究样本例数较少有关,有待将来扩大样本例数进一步观察。Mcl-1在初始治疗反应分组中有效组的阳性率为38.5%,无效组阳性率为88.2%,二者进行比较,差异有统计学意义(P < 0.05),Mcl-1阳性者对初始治疗反应差,Mcl-1的表达水平和DLBCL患者对初始治疗反应之间的相关性得到验证。随后应用二元logistic回归模型分析,深入探讨了Mcl-1的表达能否预测患者对初始治疗的反应:Mcl-1表达的logistic回归分析显示,Mcl-1表达对初始治疗的预测[OR=0.064,95%CI(0.001~0.405),P=0.004]。Mcl-1表达阳性组的治疗有效概率是阴性组的0.064倍,即Mcl-1表达阳性组对初始治疗无效的概率是阴性组的15.625倍。因此Mcl-1表达可作为DLBCL对初始治疗反应不佳的预测因素。
本研究同时对比了Bcl-2在DLBCL中的表达以及Bcl-2对DLBCL患者初始治疗反应的预测能力。BcL-2是抗凋亡蛋白家族中的最经典的抗凋亡分子之一,在DLBCL中,Bcl-2过表达主要是t(14;18)突变,致免疫球蛋白重链的增强子和Bcl-2基因相融合,见于GCB类型的DLBCL,non-GCB类型DLBCL中Bcl-2的高表达则可能和NF-KB激活相关[22]。文献报道,DLBCL患者约30%存在Bcl-2高表达[23],与较差的总生存期和无进展生存期相关,提示预后不佳[24],并且原因可能是对化疗药物的耐药性增加。本研究Bcl-2表达对初始治疗效果的预测[OR=0.158,95%CI(0.032~0.784),P>0.05],表明Bcl-2的表达水平不能作为DLBCL患者对初始治疗反应的预测因素,其原因最可能是由于不可抗因素,本试验的样本数量较少,导致试验结果存在偏差。
结合本研究及相关文献,Mcl-1和Bcl-2在DLBCL中的表达均与患者对化疗产生耐药性相关,提示对常规及免疫化疗的治疗反应差及预后不良。因此,本研究对Mcl-1和Bcl-2进行双表达联合建模,进一步探讨Mcl-1和Bcl-2双表达对DLBCL患者治疗反应的预测价值。结果显示双表达的AUC=0.924(P < 0.05),灵敏度为0.662,特异度为0.927。两者共表达可作为判断DLBCL患者预后不佳的独立预后因素,双表达的AUC大于2个指标单因素预测的AUC,说明联合预测模型的效果要优于Mcl-1或Bcl-2表达的单独预测模型,Bcl-1和Mcl-1共表达患者初始治疗无效的可能性高于Mcl-1或Bcl-2单表达者。鉴于有限的病例数量,有待将来扩大样本量进一步证实。
国内外学者对Bcl-2和其蛋白共表达对DLBCL的临床意义进行了多项研究,如SELlL蛋白与Bcl-2共表达可能在DLBCL的发生发展中具有协同作用[22],MYC和Bcl-2共表达的DLBCL患者临床分期高,临床治疗不缓解比例高,且5年总生存率低[25-26]。但迄今为止,尚无Mcl-1和Bcl-2共表达对DLBCL的临床意义的相关研究数据,结合对Bcl-2蛋白家族的不断深入认识和本研究数据,本研究认为,进一步探索Mcl-1和Bcl-2共表达对DLBCL的意义,为将来开展DLBCL的个体化病情评估和治疗效果评估提供新方向,为难治/复发DLBCL提供更有效的精准靶向治疗新方法,将是极具临床价值的研究趋势。
利益冲突 所有作者均声明不存在利益冲突
-
表 1 43例DLBCL患者临床特征
临床特征 例数 百分比/% 性别 男 21 48.8 女 22 51.2 年龄/岁 ≥60 31 72.1 < 60 12 27.9 B症状 是 11 25.6 否 32 74.4 结外受累 是 28 65.1 否 15 34.9 Ann Arbor分期 Ⅰ+Ⅱ 17 39.5 Ⅲ+Ⅳ 26 60.5 IPI积分 低危组(低危+低中危) 22 51.2 高危组(高危+高中危) 21 48.8 分子亚型 GCB 18 41.9 non-GCB 25 58.1 乳酸脱氢酶(LDH) 正常 27 62.8 升高(>250 U/L) 16 37.2 β2-微球蛋白 正常 29 67.4 升高(>2.64 mg/L) 14 32.6 Bcl-2表达 阳性 21 48.8 阴性 22 51.2 Ki67表达 阳性 31 72.1 阴性 12 27.9 初始治疗反应 有效 26 60.5 无效 17 39.5 表 2 Mcl-1和Bcl-2双表达曲线下面积
检验变量 AUC SE 95%CI 灵敏度 特异度 下限值 上限值 Mcl-1表达 0.687 0.004 0.002 0.452 0.624 0.15 Bcl-1表达 0.612 0.105 0.041 0.814 0.651 0.710 双表达 0.924 0.002 0.014 0.897 0.662 0.927 -
[1] Li Y, Wang Y, Wang Z, et al. Racial differences in three major NHL subtypes: descriptive epidemiology[J]. Cancer Epidemiol, 2015, 39(1): 8-13. doi: 10.1016/j.canep.2014.12.001
[2] Chiappella A, Santambrogio E, Castellino A, et al. Integrating novel drugs to chemoimmunotherapy in diffuse large B-cell lymphoma[J]. Expert Rev Hematol, 2017, 10(8): 697-705. doi: 10.1080/17474086.2017.1350164
[3] Dey J, Deckwerth TL, Kerwin WS, et al. Voruciclib, a clinical stage oral CDK9 inhibitor, represses mcl-1 and sensitizes high-risk Diffuse Large B-cell Lymphoma to bcl2 inhibition[J]. Sci Rep, 2017, 7(1): 18007-18017. doi: 10.1038/s41598-017-18368-w
[4] De Jong M, Langendonk M, Reitsma B, et al. Heterogeneous pattern of dependence on anti-apoptotic BCL-2 family proteins upon CHOP treatment in diffuse large B-cell lymphoma[J]. Int J Mol Sci, 2019, 20(23): 6036-6050. doi: 10.3390/ijms20236036
[5] 魏华萍, 赵小利, 王全顺, 等. BCL-2蛋白在弥漫大B细胞淋巴瘤中的表达及预后价值[J]. 中国实验血液学杂志, 2015, 23(6): 1607-1611. https://www.cnki.com.cn/Article/CJFDTOTAL-XYSY201506019.htm
[6] Friedrichs K, Gluba S, Eidtmann H, et al. Overexpression of p53 and prognosis in breast cancer[J]. Cancer, 1993, 72(12): 3641-3647. doi: 10.1002/1097-0142(19931215)72:12<3641::AID-CNCR2820721215>3.0.CO;2-8
[7] 杨漾, 张义成. 自体造血干细胞移植及CAR-T细胞疗法在复发/难治弥漫性大B细胞淋巴瘤中的应用进展[J]. 临床血液学杂志, 2023, 36(9): 622-626. doi: 10.13201/j.issn.1004-2806.2023.09.003
[8] Van Attekum M, Terpstra S, Slinger E, et al. Macrophages confer survival signals via CCR1-dependent translational MCL-1 induction in chronic lymphocytic leukemia[J]. Oncogene, 2017, 36(26): 3651-3660. doi: 10.1038/onc.2016.515
[9] Krajewski S, Bodrug S, Gascoyne R, et al. Immunohistochemical analysis of Mcl-1 and Bcl-2 proteins in normal and neoplastic lymph nodes[J]. Am J Pathol, 1994, 145(3): 515-25.
[10] Soini Y, Raunio H, Pääkkö P. High-grade malignant non-Hodgkin's lymphomas differ from low-grade lymphomas in the extent of apoptosis and their expression of bcl-2, mcl-1, bax and p53[J]. Tumour Biol, 1998, 19(3): 176-185. doi: 10.1159/000030005
[11] Bannerji R, Kitada S, Flinn IW, et al. Apoptotic-regulatory and complement-protecting protein expression in chronic lymphocytic leukemia: relationship to in vivo rituximab resistance[J]. J Clin Oncol, 2003, 21(8): 1466-1471. doi: 10.1200/JCO.2003.06.012
[12] Yi X, Sarkar A, Kismali G, et al. AMG-176, an Mcl-1 antagonist, shows preclinical efficacy in chronic lymphocytic leukemia[J]. Clin Cancer Res, 2020, 26(14): 3856-3867. doi: 10.1158/1078-0432.CCR-19-1397
[13] Derenne S, Monia B, Dean NM, et al. Antisense strategy shows that Mcl-1 rather than Bcl-2 or Bcl-x(L)is an essential survival protein of human myeloma cells[J]. Blood, 2002, 100(1): 194-199. doi: 10.1182/blood.V100.1.194
[14] Sillar JR, Enjeti AK. Targeting apoptotic pathways in acute myeloid leukaemia[J]. Cancers(Basel), 2019, 11(11): 1660.
[15] Li XX, Zhou JD, Wen XM, et al. Increased MCL-1 expression predicts poor prognosis and disease recurrence in acute myeloid leukemia[J]. Onco Targets Ther, 2019, 12: 3295-3304. doi: 10.2147/OTT.S194549
[16] Dengler MA, Teh CE, Thijssen R, et al. Potent efficacy of MCL-1 inhibitor-based therapies in preclinical models of mantle cell lymphoma[J]. Oncogene, 2020, 39(9): 2009-2023. doi: 10.1038/s41388-019-1122-x
[17] Nguyen T, Parker R, Zhang Y, et al. Homoharringtonine interacts synergistically with bortezomib in NHL cells through MCL-1 and NOXA-dependent mechanisms[J]. BMC Cancer, 2018, 18(1): 1129. doi: 10.1186/s12885-018-5018-x
[18] Khoury JD, Medeiros LJ, Rassidakis GZ, et al. Expression of Mcl-1 in mantle cell lymphoma is associated with high-grade morphology, a high proliferative state, and p53 overexpression[J]. J Pathol, 2003, 199(1): 90, 97.
[19] Williams MM, Elion DL, Rahman B, et al. Therapeutic inhibition of Mcl-1 blocks cell survival in estrogen receptor-positive breast cancers[J]. Oncotarget, 2019, 10(52): 5389-5402. doi: 10.18632/oncotarget.27070
[20] Yu Q, Liu ZY, Chen Q, et al. Mcl-1 as a potential therapeutic target for human hepatocelluar carcinoma[J]. J Huazhong Univ Sci Technolog Med Sci, 2016, 36(4): 494-500. doi: 10.1007/s11596-016-1614-7
[21] Song L, Coppola D, Livingston S, et al. Mcl-1 regulates survival and sensitivity to diverse apoptotic stimuli in human non-small cell lung cancer cells[J]. Cancer Biol Ther, 2005, 4(3): 267-276. doi: 10.4161/cbt.4.3.1496
[22] 舒炎, 詹鹤琴, 刘蒙蒙, 等. 弥漫大B细胞淋巴瘤中SEL1 L、BCL-2的表达及意义[J]. 临床与实验病理学杂志, 2018, 34(2): 153-157. https://www.cnki.com.cn/Article/CJFDTOTAL-LSBL201802009.htm
[23] Huang JZ, Sanger WG, Greiner TC, et al. The t(14;18) defines a unique subset of diffuse large B-cell lymphoma with a germinal center B-cell gene expression profile[J]. Blood, 2002, 99(7): 2285-2290. doi: 10.1182/blood.V99.7.2285
[24] 陈文婷, 姚红霞, 吴从明, 等. MYC、BCL-2和BCL-6检测在弥漫性大B细胞淋巴瘤患者预后判断中的价值[J]. 中国实验血液学杂志, 2019, 27(2): 452-457. https://www.cnki.com.cn/Article/CJFDTOTAL-XYSY201902027.htm
[25] 胡名娟, 李国伟, 欧阳小明. 弥漫大B细胞淋巴瘤中MYC和BCL-2蛋白共表达的临床病理意义[J]. 中南医学科学杂志, 2017, 45(3): 283-287. https://www.cnki.com.cn/Article/CJFDTOTAL-HYYY201703017.htm
[26] 黄亚妮, 戈伟. MYC/Bcl-2蛋白共表达与弥漫性大B细胞淋巴瘤临床特征的关系及其对预后的影响[J]. 中国医药导报, 2018, 15(31): 76-79. https://www.cnki.com.cn/Article/CJFDTOTAL-YYCY201831019.htm
-




 下载:
下载: