The effect and prognostic evaluation of oligoclonal protein bands and/or immune-globulinisotype switch to multiple myeloma
-
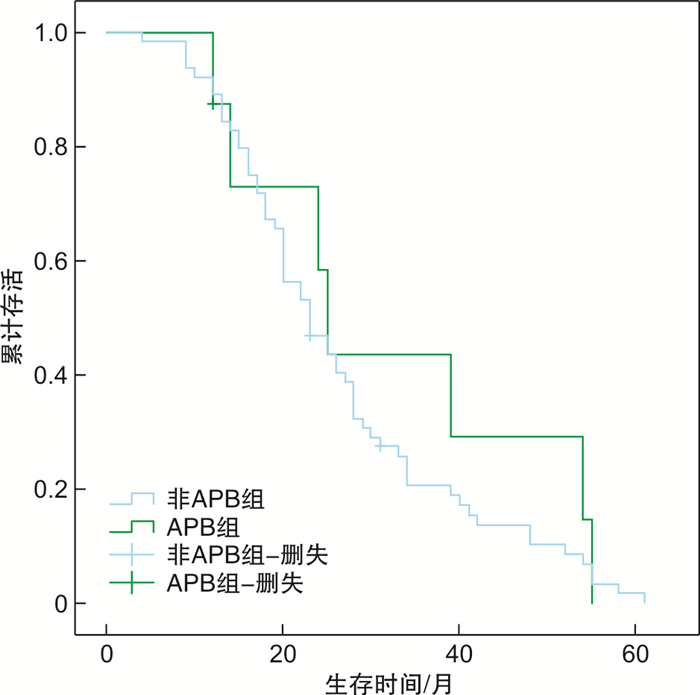
摘要: 目的 研究多发性骨髓瘤(MM)治疗后出现寡克隆条带和(或)Ig同型转换对疗效和预后评价的意义。方法 回顾性分析2018年8月—2021年7月接受化疗、自体造血干细胞移植(ASCT)、嵌合抗原受体T细胞(CAR-T)治疗的连续入组的72例MM患者的临床资料,应用免疫固定电泳检测M蛋白。结果 8例(11.1%)患者发生异常蛋白条带(APB),APB持续中位时间为2.5(1.1,6.3)个月,诊断MM至出现APB的中位时间为12.5(9.5,34.8)个月,发生APB前的末次治疗至出现APB的中位时间为2.2(0.7,5.7)个月。APB的发生与性别、年龄、ECOG评分、肌酐、血钙、乳酸脱氢酶、血红蛋白、血小板计数、骨髓浆细胞比例、染色体核型等基线特点无关,与β2-微球蛋白和总蛋白水平相关(P< 0.05)。APB组≥非常好的部分缓解率明显高于非APB组(100.0% vs 42.2%),差异有统计学意义(P=0.002)。APB组患者的中位生存期为25(95%CI18~27)个月,非APB组患者的中位生存期为23(95%CI18~27)个月,2组比较差异无统计学意义。接受化疗和ASCT治疗的患者中,APB组较非APB组的生存时间长,但差异无统计学意义;接受CAR-T细胞治疗的患者中,非APB组的中位生存时间为23(95%CI20~28)个月,明显低于APB组的54(95%CI39~54)个月,差异有统计学意义(P=0.028)。结论 在不同方案治疗后出现APB的患者具有更好的疗效;CAR-T细胞治疗后发生APB的患者预后更好。
-
关键词:
- 多发性骨髓瘤 /
- 异常蛋白条带 /
- 蛋白酶体抑制剂 /
- 自体造血干细胞移植 /
- 嵌合抗原受体T细胞治疗
Abstract: Objective To investigate the effect and prognostic evaluation of oligoclonal protein bands and/or immune-globulin(Ig) isotype switch among multiple myeloma(MM) patients.Methods A total of 72 MM patients who received chemotherapy, autologous hematopoietic stem cell transplantation(ASCT), and chimeric antigen receptor T-cell(CAR-T) therapy from August 2018 to July 2021 were retrospectively analyzed. Monoclonal protein was detected by immunofixation electrophoresis.Results Abnormal protein band(APB) occurred in 8(11.1%) MM patients. The median duration of APB was 2.5(1.1, 6.3) months. The median time from diagnosis and the last treatment of MM to the onset of APB was 12.5(9.5, 34.8) and 2.2(0.7, 5.7) months, respectively. The occurrence of APB was not related to baseline characteristics such as sex, age, ECOG score, creatinine, serum calcium, lactate dehydrogenase, hemoglobin, platelet count, bone marrow plasma cell ratio, chromosome karyotype, but was related to the level of β2-microglobulin and total protein(P< 0.05). The very good partial response rate in the APB group was significantly higher than that in the non-APB group(100.0% vs 42.2%,P=0.002). The median overall survival in the APB group was 25(95%CI18-27) months, and in the non-APB group was 23(95%CI18-27) months, there was no significant difference between the two groups. The median overall survival of patients with APB in the chemotherapy group and the ASCT group seemed longer than that of patients without APB, but there was no significant difference. Among patients who received CAR-T cell therapy, the median overall survival in patients without APB was 23(95%CI20-28) months, which was significantly lower than that of 54(95%CI39-54) months in patients with APB(P=0.028).Conclusion Patients who had APB have a better response to chemotherapy, ASCT, or CAR-T cell therapy. The occurrence of APB suggests a better prognosis in MM patients who received CAR-T cell therapy. -

-
表 1 APB患者M蛋白类型
序号 年龄/岁 性别 原始类型 治疗方式 APB 确诊到出现APB的时间/月 出现APB时的疗效 1 74 男 IgA λ 化疗 IgG κ 6 VGPR 2 68 男 IgA 化疗 IgA κ 9 VGPR 3 78 女 κ 化疗 IgG κ 11 VGPR 4 61 男 κ ASCT IgG λ 12 CR 5 62 女 λ ASCT IgG λ 34 CR 6 55 男 IgD λ CAR-T λ 35 CR 7 47 男 IgD λ CAR-T IgG 36 CR 8 60 男 IgA κ CAR-T IgG λ 13 CR 表 2 发生APB和未发生APB患者间临床特征比较
临床特征 发生APB 未发生APB χ2/U P 例数 8 64 性别/例(%) 0.455 男 6(75.0) 36(56.3) 女 2(25.0) 28(43.7) 年龄/岁 61(55,74) 60(56,66) 284.0 0.616 ECOG评分/分 1(1,2) 1(1,2) 242.5 0.789 β2-MG/(μg·L-1) 2 302.0(2 105.0,4 579.0) 5 192.0(3 083.8,7 772.5) 142.5 0.042 总蛋白/(g·L-1) 74.5(58.4,90.2) 92.0(73.6,105.9) 113.5 0.013 白蛋白/(g·L-1) 41.2(38.4,41.9) 36.1(31.5,40.1) 342.0 0.066 肌酐/(μmol·L-1) 70.0(48.0,147.0) 69.0(54.0,114.3) 282.0 0.641 血钙/(mmol·L-1) 2.2(2.1,2.5) 2.2(2.0,2.4) 262.5 0.411 LDH/(mmol·L-1) 260.0(156.0,392.0) 176.5(149.3,251.8) 314.5 0.186 血红蛋白/(g·L-1) 82.0(66.0,101.0) 88.5(72.0,110.3) 211.5 0.425 血小板计数/(×109·L-1) 148.0(73.0,193.0) 157.0(107.0,205.0) 214.0 0.452 骨髓浆细胞比例/% 28.0(32.0,47.0) 33.5(16.1,57.1) 248.0 0.999 细胞遗传/例(%) 0.277 0.599 染色体正常 7(87.5) 51(79.7) 染色体异常 1(12.5) 13(20.3) ISS分期/例(%) 9.654 0.008 Ⅰ期 4(50.0) 7(10.9) Ⅱ期 3(37.5) 22(34.4) Ⅲ期 1(12.5) 35(54.7) 类型/例(%) 12.353 0.015 IgA 3(37.5) 10(15.6) IgD 2(25.0) 4(6.3) IgG 0 39(60.9) λ/κ 3(37.5) 9(14.1) 未分泌 0 2(3.1) 治疗方案/例(%) 0.113 0.945 化疗 3(37.5) 27(42.2) ASCT 2(25.0) 13(20.3) CAR-T 3(37.5) 24(37.5) 表 3 APB发生影响因素的logistic回归模型
ISS分期 β SE OR 95% CI P Ⅰ期 1(reference) Ⅱ期 -1.047 1.223 0.35 0.03~3.85 0.392 Ⅲ期 -3.135 1.392 0.04 0.01~0.67 0.024 表 4 CAR-T细胞治疗后发生APB和未发生APB患者间临床特征比较
临床特征 未发生APB 发生APB χ2/U P 例数 24 3 性别/例(%) 0.545 男 17(70.8) 3(100.0) 女 7(29.2) 0 年龄/岁 59(56,64) 55(47,55) 18.5 0.187 β2-MG/(μg·L-1) 3 789.0(3 017.0,6 753.0) 2 105.0(1 987.0,2 105.0) 4.5 0.008 总蛋白/(g·L-1) 93.8(69.0,104.9) 74.5(58.4,74.5) 23.5 0.351 白蛋白/(g·L-1) 36.7(33.0,39.5) 41.2(41.0,41.2) 59.5 0.041 肌酐/(μmol·L-1) 66.0(54.0,87.0) 48.0(47.0,48.0) 27.5 0.532 血钙/(mmol·L-1) 2.2(2.0,2.3) 2.2(2.1,2.2) 38.0 0.914 LDH/(mmol·L-1) 173.0(144.0,241.0) 260.0(144.0,260.0) 48.5 0.351 血红蛋白/(g·L-1) 70.0(75.0,106.0) 73.0(69.0,73.0) 19.0 0.215 血小板计数/(×109·L-1) 164.0(108.0,209.0) 73.0(69.0,73.0) 20.5 0.245 骨髓浆细胞比例/% 35.0(19.0,49.0) 32.0(15.0,32.0) 33.0 0.856 ISS分期/例(%) 17.6 < 0.001 Ⅰ期 0 2(66.7) Ⅱ期 12(50.0) 1(33.3) Ⅲ期 12(50.0) 0 类型/例(%) 6.7 0.150 IgA 4(16.7) 1(33.3) IgD 3(12.5) 2(66.7) IgG 12(50.0) 0 λ/κ 3(12.5) 0 未分泌 2(8.3) 0 -
[1] 王亚茹, 马艳萍. 伊沙佐米治疗复发难治性多发性骨髓瘤的临床疗效及安全性分析[J]. 临床血液学杂志, 2021, 34(9): 655-659. https://www.cnki.com.cn/Article/CJFDTOTAL-LCXZ202109011.htm
[2] Cullis J. Haematology: Multiple Myeloma[J]. Clin Med(Lond), 2019, 19(2): 188.
[3] Tovar N, de Larrea CF, Aróstegui JI, et al. Natural history and prognostic impact of oligoclonal humoral response in patients with multiple myeloma after autologous stem cell transplantation: long-term results from a single institution[J]. Haematologica, 2013, 98(7): 1142-1146. doi: 10.3324/haematol.2013.084350
[4] 刘俊茹, 李娟. 《中国多发性骨髓瘤诊治指南(2017年修订)》疗效标准部分的解读[J]. 中华内科杂志, 2017, 56(11): 800-803.
[5] 黄建玲, 黄木荣, 潘碧燕, 等. Ig同型转换及寡克隆蛋白条带在免疫固定电泳图谱中的形态特点及其对多发性骨髓瘤患者骨髓移植疗效评价的意义[J]. 检验医学与临床, 2016, 13(6): 783-785. https://www.cnki.com.cn/Article/CJFDTOTAL-JYYL201606024.htm
[6] 王荷花, 李娟, 刘俊茹, 等. 异常蛋白条带在含硼替佐米方案诱导序贯自体造血干细胞移植治疗多发性骨髓瘤患者中的意义[J]. 中华血液学杂志, 2013, 34(4): 327-331.
[7] Fernández de Larrea C, Tovar N, Cibeira MT, et al. Emergence of oligoclonal bands in patients with multiple myeloma in complete remission after induction chemotherapy: association with the use of novel agents[J]. Haematologica, 2011, 96(1): 171-173. doi: 10.3324/haematol.2010.030882
[8] Hovenga S, de Wolf JT, Guikema JE, et al. Autologous stem cell transplantation in multiple myeloma after VAD and EDAP courses: a high incidence of oligoclonal serum Igs post transplantation[J]. Bone Marrow Transplant, 2000, 25(7): 723-728. doi: 10.1038/sj.bmt.1702194
[9] Wadhera RK, Kyle RA, Larson DR, et al. Incidence, clinical course, and prognosis of secondary monoclonal gammopathy of undetermined significance in patients with multiple myeloma[J]. Blood, 2011, 118(11): 2985-2987. doi: 10.1182/blood-2011-04-349175
[10] Mark T, Jayabalan D, Coleman M, et al. Atypical serum immunofixation patterns frequently emerge in immunomodulatory therapy and are associated with a high degree of response in multiple myeloma[J]. Br J Haematol, 2008, 143(5): 654-660. doi: 10.1111/j.1365-2141.2008.07374.x
[11] Byrne E, Giles C, Andrews J, et al. Lack of correlation between emergence of an abnormal protein band or of oligoclonal bands and survival in patients with multiple myeloma achieving complete remission following autologous stem cell transplantation[J]. Haematologica, 2011, 96(4): e29. doi: 10.3324/haematol.2011.041509
[12] 刘婷利, 李护君, 姚瑶, 等. IgA型多发性骨髓瘤患者预后因素分析[J]. 临床血液学杂志, 2019, 32(1): 28-31. https://www.cnki.com.cn/Article/CJFDTOTAL-LCXZ201901008.htm
[13] 陶中飞, 傅卫军, 陈玉宝, 等. 206例多发性骨髓瘤预后因素分析及分期评价[J]. 癌症, 2006, 25(4): 461-464. https://www.cnki.com.cn/Article/CJFDTOTAL-AIZH200604016.htm
[14] de Larrea CF, Cibeira MT, Elena M, et al. Abnormal serum free light chain ratio in patients with multiple myeloma in complete remission has strong association with the presence of oligoclonal bands: implications for stringent complete remission definition[J]. Blood, 2009, 114(24): 4954-4956. doi: 10.1182/blood-2009-06-224832
[15] Zent CS, Wilson CS, Tricot G, et al. Oligoclonal protein bands and Ig isotype switching in multiple myeloma treated with high-dose therapy and hematopoietic cell transplantation[J]. Blood, 1998, 91(9): 3518-3523. doi: 10.1182/blood.V91.9.3518
[16] Ruben N, Jayabalan DS, Christos PJ, et al. BiRD(Biaxin[clarithromycin]/Revlimid[lenalidomide]/dexamethasone)combination therapy results in high complete- and overall-response rates in treatment-naive symptomatic multiple myeloma[J]. Blood, 2008, 111(3): 1101-1109. doi: 10.1182/blood-2007-05-090258
-




 下载:
下载: