Efficacy and safety of interferon-α in patients with polycythemia vera and essential thrombocythemia
-
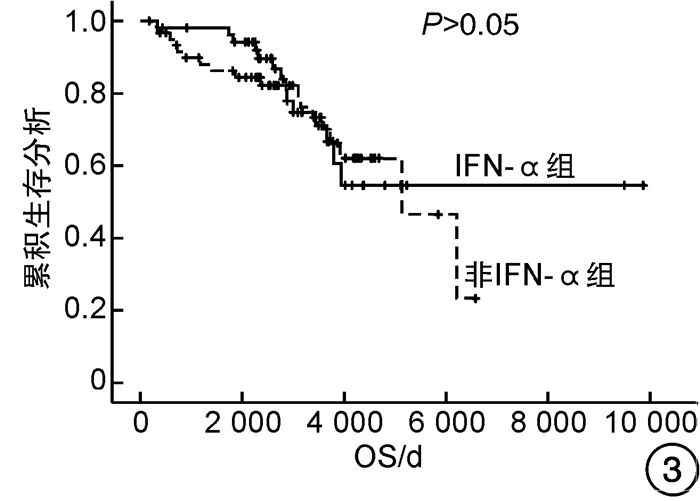
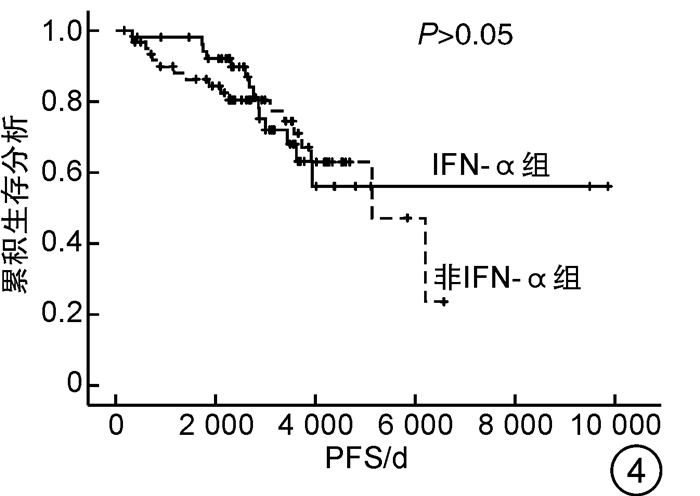
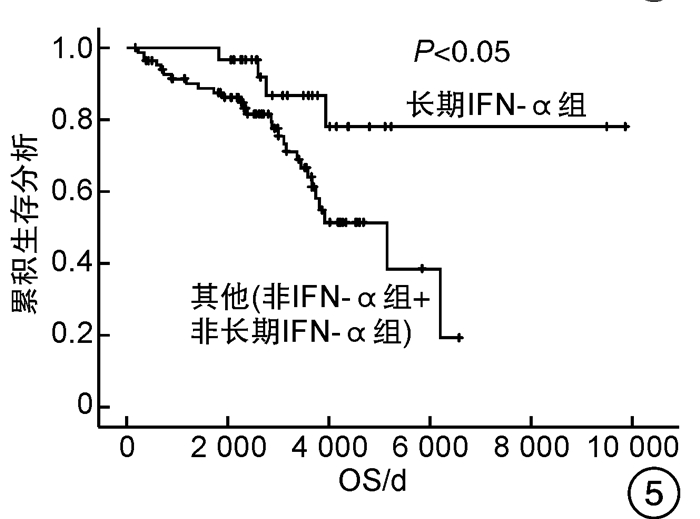
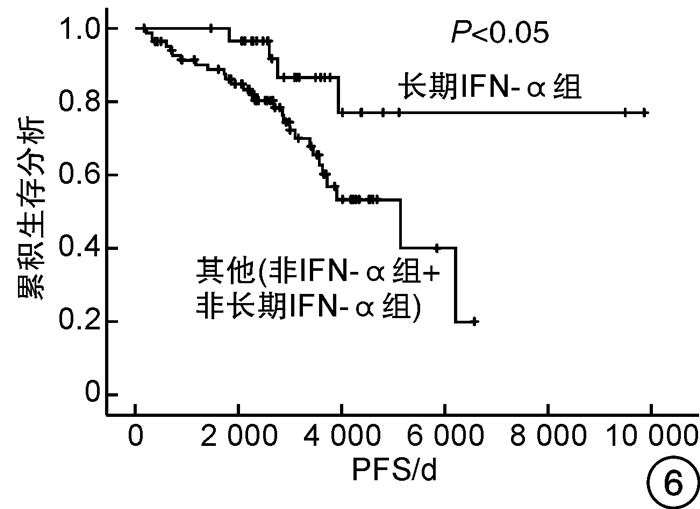
摘要: 目的 观察干扰素-α(interferon-α,IFN-α)治疗真性红细胞增多症(polycythemia vera,PV)和原发性血小板增多症(essential thrombocythemia,ET)患者的有效性和安全性,探索IFN-α的长期使用是否会改善患者的预后。方法 回顾性分析2007年5月—2017年9月诊治的67例PV及48例ET患者的临床资料,根据治疗方案分为IFN-α组(53例)和非IFN-α组(62例),同时将IFN-α组的53例患者根据IFN-α使用时间分为长期IFN-α组(30例)和非长期IFN-α组(23例),比较各组患者的疗效和安全性。结果 IFN-α组血液学总有效率为81.1%,高于非IFN-α组的69.4%。至随访截止时,IFN-α组和非IFN-α组间总生存期和无进展生存期比较差异均无统计学意义,而长期IFN-α组(30例)患者的总生存期和无进展生存期均明显优于非IFN-α组和非长期IFN-α组(85例)患者(P<0.05),且随访期间无严重不良反应发生。结论 长期持续应用IFN-α治疗PV和ET患者是安全的,并且在生存方面长期应用较非长期应用治疗有优势。Abstract: Objective To observe the efficacy and safety of interferon-α(IFN-α) in the treatment of patients with polycythemia vera(PV) and essential thrombocythemia(ET), and explore whether the long-term use of IFN-α will improve the prognosis of patients.Methods The clinical data of 67 patients with PV and 48 patients with ET diagnosed and treated from May 2007 to September 2017 were retrospectively analyzed. According to the treatment regimens, patients were divided into the IFN-α group (53 cases) and the non-IFN-α group (62 cases), while 53 patients in the IFN-α group were divided into the long-term IFN-α group (30 cases) and non-long-term IFN-α group (23 cases) according to the usage time of IFN-α. The efficacy and safety of patients in each group were compared.Results The overall response rate of the IFN-α group was 81.1%, which was higher than 69.4% of the non-IFN-α group. By the end of follow-up, there was no significant difference in the overall survival and progression-free survival between the IFN-α group and the non-IFN-α group, while the overall survival and progression-free survival of the 30 patients in the long-term IFN-α group were significantly better than those of the other 85 patients in the non-IFN-α group and non-long-term IFN-α group(P < 0.05). There were no serious adverse events that occurred during the follow-up.Conclusion Long-term continued use of IFN-α in PV and ET patients is safe, and it has survival advantages compared to non-long-term treatment.
-
Key words:
- polycythemia vera /
- essential thrombocythemia /
- interferon-α /
- efficacy /
- safety
-

-
表 1 PV和ET患者临床特征比较
基线特征 PV(n=67) ET(n=48) 合计(n=115) χ2 P 男∶女/例 43∶24 22∶26 65∶50 3.830 0.050 中位年龄(范围)/岁 59(31~85) 72(22~89) 63(22~89) 0.004 年龄≥60岁/例(%) 33(49.3) 35(72.9) 68(59.1) 6.480 0.011 心血管危险因素/例(%) 51(76.1) 35(72.9) 86(74.8) 0.152 0.697 既往血栓形成/出血史/例(%) 21(31.3) 19(39.6) 40(34.8) 0.837 0.360 脾肿大/例(%) 37(55.2) 22(45.8) 59(51.3) 0.987 0.320 JAK2V617F阳性/例(%) 45(67.2) 34(70.8) 79(68.7) 0.175 0.676 中位白细胞数(范围)/(×109/L) 10.7(3.7~25.1) 10.4(4.5~25.9) 10.6(3.7~25.9) 0.485 中位血红蛋白(范围)/(×109/L) 195(148~253) 137(28~183) 174(28~253) <0.001 中位血小板数(范围)/(×109/L) 297(42~791) 902(410~1 787) 521(42~1 787) <0.001 危险分层/例(%) 5.654 0.059 低危 20(29.9) 6(12.5) 26(22.6) 中危 19(28.4) 21(43.8) 40(34.8) 高危 28(41.8) 21(43.8) 49(42.6) 表 2 IFN-α组与非IFN-α组临床特征比较
临床特征 IFN-α组(n=53) P3 非IFN-α组(n=62) P1 长期IFN-α组(n=30) P2 非长期IFN-α组(n=23) 男∶女/例 16∶14 0.026 19∶4 0.682 30∶32 0.057 年龄≥60岁/例(%) 15(50.0) 0.431 14(60.9) 0.237 39(62.9) 0.373 中位年龄(范围)/岁 60(22~85) 0.484 65(31~87) 0.493 64(31~89) 0.829 心血管危险因素/例(%) 25(83.3) 1.000 19(82.6) 0.210 42(67.7) 0.060 既往血栓形成/出血史/例(%) 10(33.3) 0.663 9(39.1) 0.846 21(33.9) 0.824 脾肿大/例(%) 16(53.3) 0.933 12(52.2) 0.796 31(50.0) 0.762 JAK2V617F阳性/例(%) 20(66.7) 0.353 18(78.3) 0.780 41(66.1) 0.521 危险分层/例(%) 0.249 0.398 0.970 低危 9(30.0) 3(13.0) 14(22.6) 中危 11(36.7) 8(34.8) 21(33.9) 高危 10(33.3) 12(52.2) 27(43.5) P1为IFN-α组和非IFN-α组的比较,P2为长期IFN-α组和非长期IFN-α组的比较,P3为长期IFN-α组和其他(非IFN-α组+非长期IFN-α组)的比较。 表 3 患者的短期疗效
例(%) 变量 CHR/PHR(n=86) NR/PD(n=29) P 男∶女/例 52∶34 13∶16 0.142 中位年龄(范围)/岁 60(22~89) 75(32~87) <0.001 年龄≥60岁 43(50.0) 25(86.2) 0.001 心血管危险因素 65(75.6) 21(72.4) 0.734 既往血栓形成/出血史 29(33.7) 11(37.9) 0.681 脾肿大 38(44.2) 21(72.4) 0.009 JAK2V617F阳性 57(66.3) 22(75.9) 0.336 危险分层 0.020 低危 24(27.9) 2(6.9) 中危 31(36.0) 9(31.0) 高危 31(36.0) 18(62.1) IFN-α组 43(50.0) 10(34.5) 0.147 长期IFN-α组 27(31.4) 3(10.3) 0.026 表 4 OS和PFS亚组分析
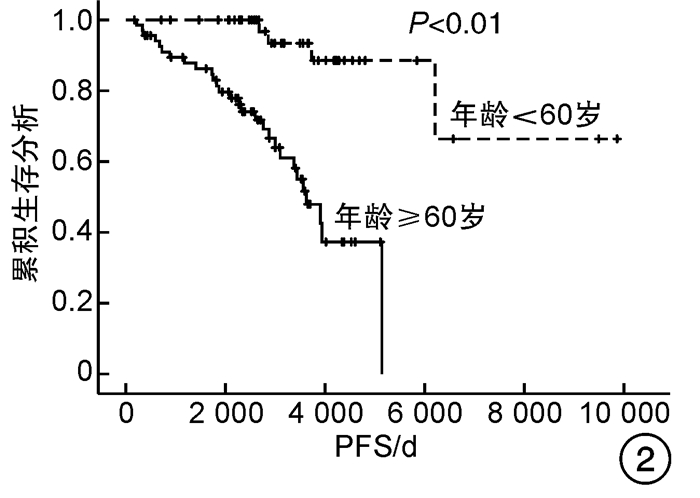
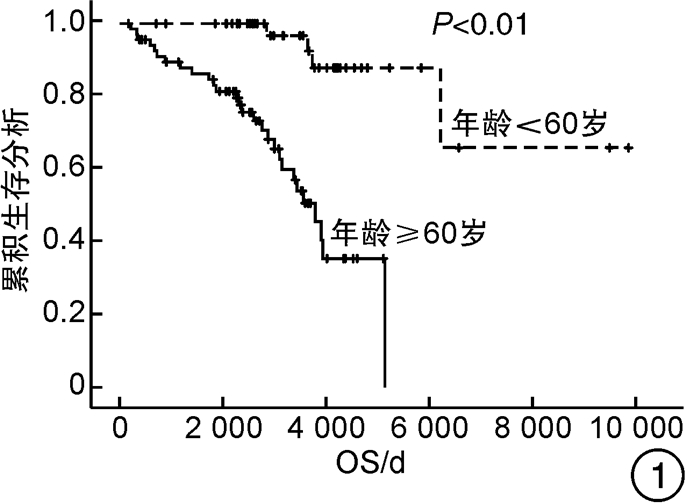
因素 OS PFS 单因素分析 多因素分析 单因素分析 多因素分析 P HR(95%CI) P P HR(95%CI) P 性别 0.617 - - 0.498 - - 年龄≥60岁 <0.001 8.135(2.354~28.115) 0.001 <0.001 7.646(2.223~26.303) 0.001 心血管危险因素 0.275 - - 0.282 - - 既往血栓形成/出血史 0.019 1.595(0.777~3.271) 0.203 0.014 1.720(0.840~3.519) 0.138 脾肿大 0.079 1.579(0.759~3.288) 0.222 0.080 1.601(0.768~3.335) 0.209 JAK2V617F 0.368 - - 0.310 - - 危险分层 <0.001 - - <0.001 - - 是否使用IFN-α 0.740 - - 0.780 - - 是否长期使用IFN-α 0.017 0.378(0.130~1.101) 0.074 0.021 0.369(0.127~1.072) 0.067 表 5 患者的不良反应
例(%) 不良反应 IFN-α组(n=53) 长期IFN-α组(n=30) 非IFN-α组(n=62) 血液学 贫血 10(18.9) 7(23.3) 14(22.6) 白细胞减少 15(28.3) 10(33.3) 11(17.7) 淋巴细胞减少 9(17.0) 4(13.3) 6(9.7) 血小板减少 7(13.2) 3(10.0) 4(6.5) 非血液学 疲劳 18(34.0) 15(50.0) 16(25.8) 腹痛腹泻 8(15.1) 4(13.3) 7(11.3) 便秘 7(13.2) 4(13.3) 4(6.5) 发热/头痛 10(18.9) 7(23.3) 5(8.1) 瘙痒 9(17.0) 7(23.3) 8(12.9) 肌肉酸痛 12(22.6) 10(33.3) 9(14.5) 恶心呕吐 11(20.8) 9(30.0) 8(12.9) 心悸 1(1.9) 1(3.3) 2(3.2) -
[1] Tefferi A, Barbui T. Polycythemia vera and essential thrombocythemia: 2021 update on diagnosis, risk-stratification and management[J]. Am J Hematol, 2020, 95(12): 1599-1613. doi: 10.1002/ajh.26008
[2] Mascarenhas J, Kosiorek HE, Prchal JT, et al. A randomized phase 3 trial of interferon-α vs hydroxyurea in polycythemia vera and essential thrombocythemia[J]. Blood, 2022, 139(19): 2931-2941. doi: 10.1182/blood.2021012743
[3] Barbui T, Tefferi A, Vannucchi AM, et al. Philadelphia chromosome-negative classical myeloproliferative neoplasms: revised management recommendations from European LeukemiaNet[J]. Leukemia, 2018, 32(5): 1057-1069. doi: 10.1038/s41375-018-0077-1
[4] How J, Hobbs G. Use of Interferon Alfa in the Treatment of Myeloproliferative Neoplasms: Perspectives and Review of the Literature[J]. Cancers(Basel), 2020, 12(7): 1954.
[5] Tefferi A, Rumi E, Finazzi G, et al. Survival and prognosis among 1545 patients with contemporary polycythemia vera: an international study[J]. Leukemia, 2013, 27(9): 1874-1881. doi: 10.1038/leu.2013.163
[6] Passamonti F, Thiele J, Girodon F, et al. A prognostic model to predict survival in 867 World Health Organization-defined essential thrombocythemia at diagnosis: a study by the International Working Group on Myelofibrosis Research and Treatment[J]. Blood, 2012, 120(6): 1197-1201. doi: 10.1182/blood-2012-01-403279
[7] Barosi G, Mesa R, Finazzi G, et al. Revised response criteria for polycythemia vera and essential thrombocythemia: an ELN and IWG-MRT consensus project[J]. Blood, 2013, 121(23): 4778-4781. doi: 10.1182/blood-2013-01-478891
[8] Vainchenker W, Kralovics R. Genetic basis and molecular pathophysiology of classical myeloproliferative neoplasms[J]. Blood, 2017, 129(6): 667-679. doi: 10.1182/blood-2016-10-695940
[9] 刘苗苗, 郭涛. 骨髓增殖性肿瘤血栓事件的治疗现状[J]. 临床血液学杂志, 2021, 34(1): 9-12. https://lcxy.whuhzzs.com/article/doi/10.13201/j.issn.1004-2806.2021.01.003
[10] Gisslinger H, Klade C, Georgiev P, et al. Ropeginterferon alfa-2b versus standard therapy for polycythaemia vera(PROUD-PV and CONTINUATION-PV): a randomised, non-inferiority, phase 3 trial and its extension study[J]. Lancet Haematol, 2020, 7(3): e196-e208. doi: 10.1016/S2352-3026(19)30236-4
[11] Yacoub A, Mascarenhas J, Kosiorek H, et al. Pegylated interferon alfa-2a for polycythemia vera or essential thrombocythemia resistant or intolerant to hydroxyurea[J]. Blood, 2019, 134(18): 1498-1509. doi: 10.1182/blood.2019000428
[12] Iurlo A, Cattaneo D, Bucelli C, et al. New Perspectives on Polycythemia Vera: From Diagnosis to Therapy[J]. Int J Mol Sci, 2020, 21(16): 5805. doi: 10.3390/ijms21165805
[13] Wagner SM, Melchardt T, Greil R. Ropeginterferon alfa-2b for the treatment of patients with polycythemia vera[J]. Drugs Today(Barc), 2020, 56(3): 195-202.
[14] Abu-Zeinah G, Krichevsky S, Cruz T, et al. Interferon-alpha for treating polycythemia vera yields improved myelofibrosis-free and overall survival[J]. Leukemia, 2021, 35(9): 2592-2601. doi: 10.1038/s41375-021-01183-8
[15] Bjørn ME, Hasselbalch HC. Minimal residual disease or cure in MPNs? Rationales and perspectives on combination therapy with interferon-alpha2 and ruxolitinib[J]. Expert Rev Hematol, 2017, 10(5): 393-404. doi: 10.1080/17474086.2017.1284583
[16] 杨家明, 赵肸, 张金盈, 等. 不同抗血小板治疗方案对急性冠状动脉综合征合并基线血小板中度减少患者预后的影响[J]. 临床心血管病杂志, 2021, 37(1): 21-27. https://www.cnki.com.cn/Article/CJFDTOTAL-LCXB202101005.htm
[17] Masarova L, Patel KP, Newberry KJ, et al. Pegylated interferon alfa-2a in patients with essential thrombocythaemia or polycythaemia vera: a post-hoc, median 83 month follow-up of an open-label, phase 2 trial[J]. Lancet Haematol, 2017, 4(4): e165-e175. doi: 10.1016/S2352-3026(17)30030-3
[18] 卢瑞, 张梦潇, 张爱边, 等. 红细胞分布宽度对原发性血小板增多症和真性红细胞增多症患者血栓形成及其预后的预测价值[J]. 临床血液学杂志, 2021, 34(11): 785-789. https://lcxy.whuhzzs.com/article/doi/10.13201/j.issn.1004-2806.2021.11.008
[19] Hasselbalch HC, Holmström MO. Perspectives on interferon-alpha in the treatment of polycythemia vera and related myeloproliferative neoplasms: minimal residual disease and cure?[J]. Semin Immunopathol, 2019, 41(1): 5-19. doi: 10.1007/s00281-018-0700-2
-




 下载:
下载: