-
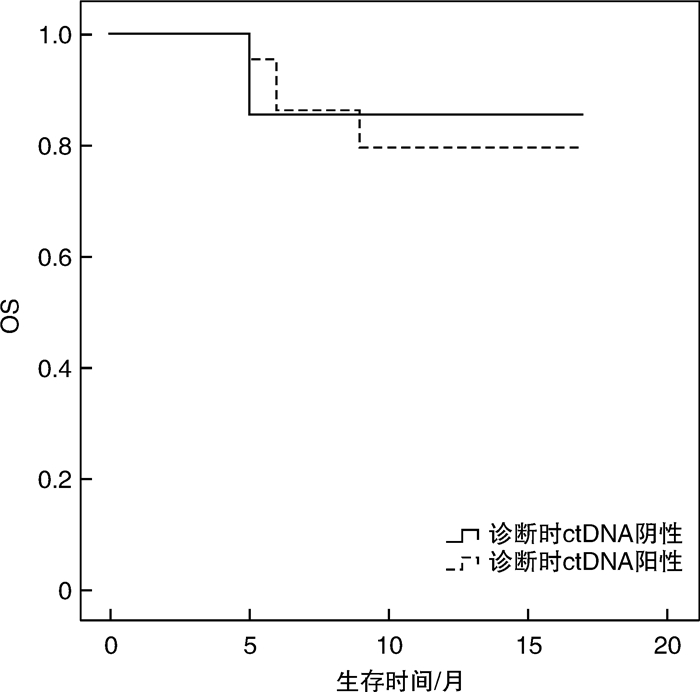
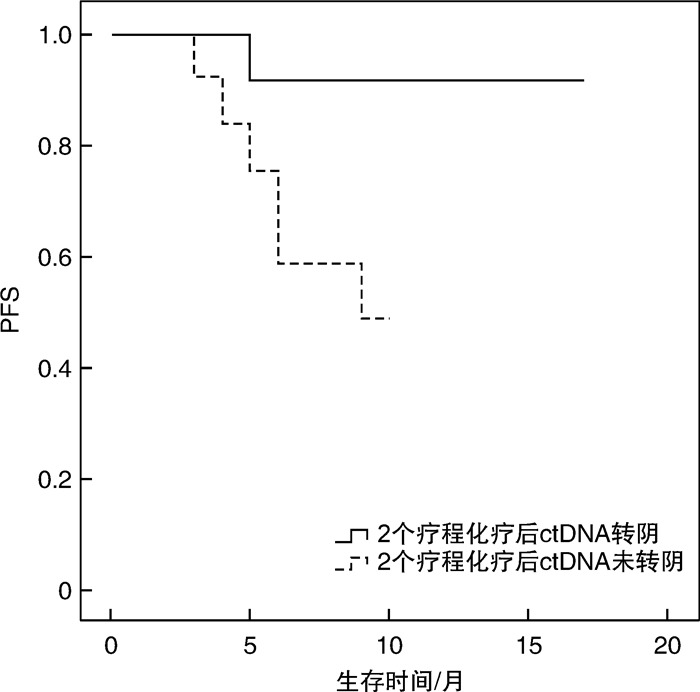
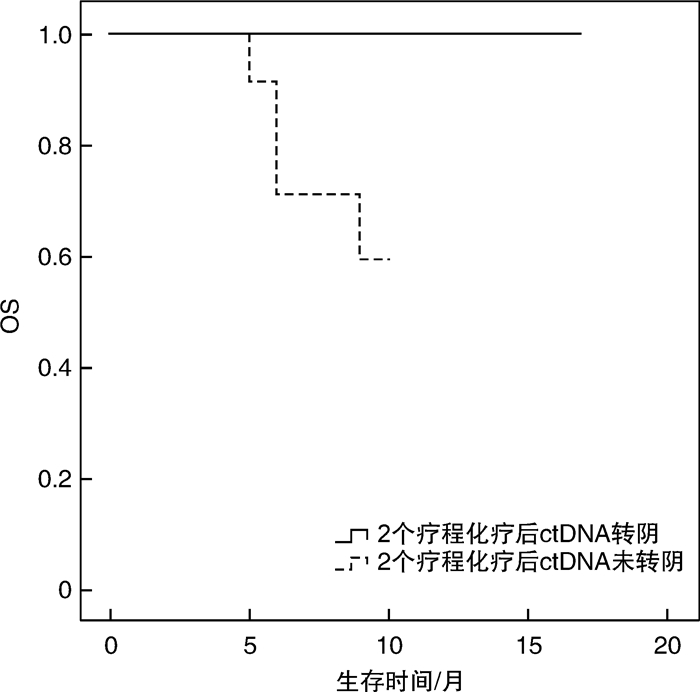
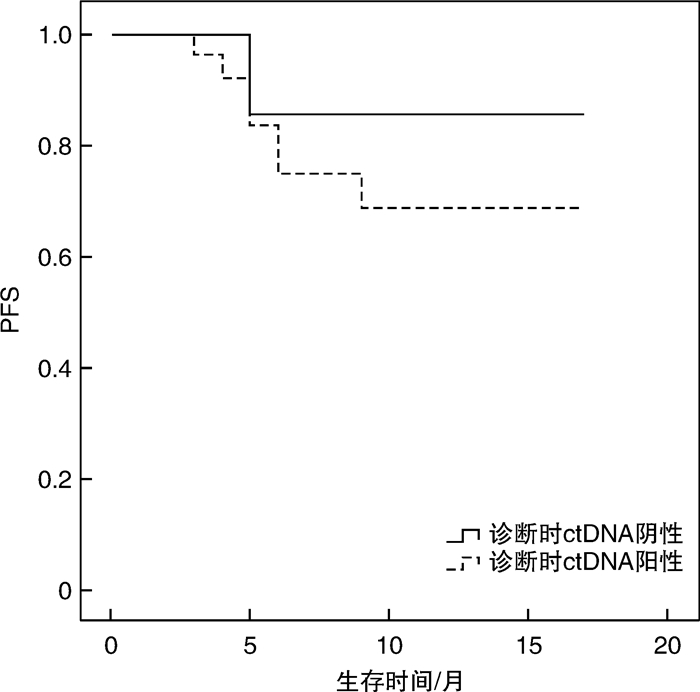
摘要: 目的 循环肿瘤DNA(ctDNA)为检测和评估恶性肿瘤提供了一种微创方法,其在血液系统恶性肿瘤中的应用价值主要是观察缓解深度,进而判断是否与预后相关,并监测早期复发。本研究探讨基于免疫球蛋白重链基因(IgH)VDJ重排的ctDNA检测在弥漫大B细胞淋巴瘤(DLBCL)的辅助诊断、疗效预测及预后评估中的潜在价值。方法 收集初诊未经治疗的DLBCL患者38例,于标准方案化疗前采集外周血标本通过二代测序法行IgH VDJ重排的ctDNA检测,初始ctDNA阳性的患者于2个疗程化疗后再次复检ctDNA,分析ctDNA在DLBCL患者中发病时的表达情况及2个疗程化疗后的表达改变,探讨其与患者临床特征的关系以及在化疗疗效和预后判断中的价值。结果 初始化疗前31例ctDNA检测呈阳性,阳性率为81.6%。初始ctDNA阳性组患者Bcl-2/MYC双表达比例显著升高(P=0.038),其余临床特征差异无统计学意义。2组患者在4个疗程化疗后的疗效评估及预后上差异亦无统计学意义。2个疗程化疗后17例ctDNA转阴,14例仍阳性。ctDNA仍阳性组具有更晚的疾病分期(P=0.021),伴有B症状(P=0.031),升高的乳酸脱氢酶水平(P=0.012),高风险IPI评分(P< 0.000 1)及骨髓累及(P=0.012)。4个疗程后完全缓解患者的ctDNA转阴率明显高于部分缓解患者(90.9% vs 38.9%,P=0.005)。ctDNA转阴组1年无进展生存率估计值为91.7%,1年总生存率估计值为100.0%,均显著优于未转阴组(P=0.036,P=0.030)。结论 初诊DLBCL患者ctDNA检测具有较高的阳性率,有助于DLBCL的辅助诊断。2个疗程化疗后ctDNA能否转阴,有助于早期进行疗效预测及短期疗效评估。Abstract: Objective Circulating tumor DNA(ctDNA) has offered a minimally invasive approach for the detection and measurement of cancer. Its application value in hematological malignancies is mainly to observe the depth of remission, and then determine whether it is related with prognosis and monitor early recurrence. This study was to investigate the potential value of ctDNA based on IgH VDJ rearrangement in diagnosis, efficacy prediction and prognostic evaluation of diffuse large B-cell lymphoma(DLBCL).Methods The peripheral blood samples from 38 newly diagnosed DLBCL patients were collected before standard chemotherapy. Next-generation sequencing was used to detect the ctDNA. Patients with initial ctDNA positive will be re-detected after 2 courses of chemotherapy. Then, the expression of ctDNA at diagnosis and after 2 courses of chemotherapy were analyzed, so as to explore the relationship between ctDNA and the clinical features and its value in the judgment of efficacy and prognosis.Results Thirty-one patients had positive ctDNA before initial treatment, while 7 patients were negative. The positive rate was 81.6%. The ratio of Bcl-2/MYC dual expression was significantly higher in the initial ctDNA positive group(P=0.038). There was no significant difference in other clinical features. Similarly, there was also no significant difference in the efficacy after 4 courses of chemotherapy and prognosis between the two groups. After 2 courses of chemotherapy, 17 cases turned ctDNA negative, while 14 cases were persistently positive. The ctDNA persistently positive group had a later stage(P=0.021), B symptoms(P=0.031), increased LDH level(P=0.012), high-risk IPI score(P< 0.000 1) and bone marrow involvement(P=0.012). The rate of the ctDNA turning negative after 4 courses of chemotherapy in patients with complete remission was significantly higher than that in patients with partial remission(90.9% vs 38.9%,P=0.005). Patients with ctDNA turning negative had a better pregression-free survival and overall survival(P=0.036,P=0.030) with the estimated 1-year pregression-free survival rate 91.7% and 1-year overall survival rate 100.0%.Conclusion The ctDNA detection in newly diagnosed DLBCL patients has a high positive rate and may assist the diagnosis of DLBCL. Whether the ctDNA turned negative after 2 courses of chemotherapy is conducive to early prediction of efficacy and short-term efficacy assessment.
-
Key words:
- circulating tumor DNA /
- diffuse large B cell lymphoma /
- efficacy /
- prognosis
-

-
表 1 初诊时ctDNA阳性组和阴性组临床特征比较
例(%) 临床特征 初诊时ctDNA情况 P 临床特征 初诊时ctDNA情况 P 阳性(31例) 阴性(7例) 阳性(31例) 阴性(7例) 性别 0.427 IPI评分 0.656 男 16(51.6) 5(71.4) 0~2分 22(71.0) 4(57.1) 女 15(48.4) 2(28.6) 3~5分 9(29.0) 3(42.9) 年龄 0.410 骨髓累及情况 0.592 ≤60岁 16(51.6) 2(28.6) 否 26(83.9) 5(71.4) >60岁 15(48.4) 5(71.4) 是 5(16.1) 2(28.6) 疾病分期 0.656 Ki-67 1.000 Ⅰ~Ⅱ期 9(29.0) 3(42.9) ≥80% 18(58.1) 4(57.1) Ⅲ~Ⅳ期 22(71.0) 4(57.1) < 80% 13(41.9) 3(42.9) 分组 1.000 CD5 0.307 不伴有B症状 20(64.5) 5(71.4) 阳性 8(25.8) 0 伴有B症状 11(35.5) 2(28.6) 阴性 23(74.2) 7(100.0) 乳酸脱氢酶 0.675 Bcl-2/MYC表达情况 0.038 正常 17(54.8) 5(71.4) 表达 19(61.3) 1(14.3) 升高 14(45.2) 2(28.6) 不表达 12(38.7) 6(85.7) 病理分型 0.569 GCB 6(19.4) 0 non-GCB 25(80.6) 7(100.0) 表 2 诊断时ctDNA阳性组和阴性组免疫化疗的疗效比较
例(%) 组别 CR PR NR ORR 诊断时ctDNA阳性组(31例) 11(35.5) 18(58.1) 2(6.4) 29(93.5) 诊断时ctDNA阴性组(7例) 3(42.9) 4(57.1) 0 7(100.0) 表 3 2个疗程化疗后ctDNA转阴组和未转阴组临床特征比较
例(%) 临床特征 2个疗程化疗后ctDNA情况 P 临床特征 2个疗程化疗后ctDNA情况 P 阴性(17例) 阳性(14例) 阴性(17例) 阳性(14例) 性别 0.479 IPI评分 < 0.000 1 男 10(58.8) 6(42.9) 0~2分 17(100.0) 5(35.7) 女 7(41.2) 8(57.1) 3~5分 0 9(64.3) 年龄 0.156 骨髓累及情况 0.012 ≤60岁 11(64.7) 5(35.7) 否 17(100.0) 9(64.3) >60岁 6(35.3) 9(64.3) 是 0 5(35.7) 疾病分期 0.021 Ki-67 0.717 Ⅰ~Ⅱ期 8(47.1) 1(7.1) ≥80% 9(52.9) 9(64.3) Ⅲ~Ⅳ期 9(52.9) 13(92.9) < 80% 8(47.1) 5(35.7) 分组 0.031 CD5 0.412 不伴有B症状 14(82.4) 6(42.9) 阳性 3(17.6) 5(35.7) 伴有B症状 3(17.6) 8(57.1) 阴性 14(82.4) 9(64.3) 乳酸脱氢酶 0.012 Bcl-2/MYC表达情况 0.461 正常 13(76.5) 4(28.6) 表达 9(52.9) 10(71.4) 升高 4(23.5) 10(71.4) 不表达 8(47.1) 4(28.6) 病理类型 0.664 GCB 4(23.5) 2(14.3) non-GCB 13(76.5) 12(85.7) -
[1] Jahr S, Hentze H, Englisch S, et al. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells[J]. Cancer Res, 2001, 61(4): 1659-1665. https://pubmed.ncbi.nlm.nih.gov/11245480/
[2] Schwarzenbach H, Hoon DS, Pantel K. Cell-free nucleic acids as biomarkers in cancer patients[J]. Nat Rev Cancer, 2011, 11(6): 426-437. doi: 10.1038/nrc3066
[3] Shu Y, Wu X, Tong X, et al. Circulating tumor DNA mutation profiling by targeted next generation sequencing provides guidance for personalized treatments in multiple cancer types[J]. Sci Rep, 2017, 7(1): 583. doi: 10.1038/s41598-017-00520-1
[4] Sefrioui D, Beaussire L, Perdrix A, et al. Direct circulating tumor DNA detection from unpurified plasma using a digital PCR platform[J]. Clin Biochem, 2017, 50(16-17): 963-966. doi: 10.1016/j.clinbiochem.2017.06.005
[5] 霍雨佳, 赵维莅. 液体活检在淋巴瘤中的应用进展[J]. 临床血液学杂志, 2020, 33(7): 517-520. https://www.cnki.com.cn/Article/CJFDTOTAL-LCXZ202007017.htm
[6] Roschewski M, Dunleavy K, Pittaluga S, et al. Circulating tumour DNA and CTmonitoring in patients with untreated diffuse large B-cell lymphoma: a correlativebiomarker study[J]. Lancet Oncol, 2015, 16(5): 541-549. doi: 10.1016/S1470-2045(15)70106-3
[7] 丁薇, 贾春花. 原发性肝癌术后外周血循环肿瘤DNA的临床意义[J]. 临床血液学杂志, 2020, 33(4): 245-247, 252. https://www.cnki.com.cn/Article/CJFDTOTAL-LCXZ202004004.htm
[8] Sabattini E, Bacci F, Sagramoso C, et al. WHO classification of tumours of haematopoietic and lymphoid tissues in 2008: an overview[J]. Pathologica, 2010, 102(3): 83-87.
[9] Kwok M, Wu SP, Mo C, et al. Circulating tumor DNA to monitor therapy for aggressive B-cell lymphomas[J]. Curr Treat Options Oncol, 2016, 17(9): 47. doi: 10.1007/s11864-016-0425-1
[10] Kurtz DM, Green MR, Bratman SV, et al. Noninvasive monitoring of diffuse large B-cell lymphoma by immunoglobulin high-throughput sequencing[J]. Blood, 2015, 125(24): 3679-3687. doi: 10.1182/blood-2015-03-635169
[11] He J, Wu J, Jiao Y, et al. IgH gene rearrangements as plasma biomarkers in non-Hodgkin's lymphoma patients[J]. Oncotarget, 2011, 2(3): 178-185. doi: 10.18632/oncotarget.235
[12] 王书楠, 白鸥. 弥漫大B细胞淋巴瘤临床预后系统与分子预后因素的研究进展[J]. 中华血液学杂志, 2016, 37(6): 538-541.
[13] Casasnovas RO, Ysebaert L, Thieblemont C, et al. FDG-PET-driven consolidation strategy in diffuse large B-cell lymphoma: final results of a randomized phase 2 study[J]. Blood, 2017, 130(11): 1315-1326. doi: 10.1182/blood-2017-02-766691
[14] Roschewski M, Staudt LM, Wilson WH. Dynamic monitoring of circulating tumor DNA in non-Hodgkin lymphoma[J]. Blood, 2016, 127(25): 3127-3132. doi: 10.1182/blood-2016-03-635219
[15] Scheijen B, Meijers R, Rijntjes J, et al. Next-generation sequencing of immunoglobulin gene rearrangements for clonality assessment: a technical feasibility study by EuroClonality-NGS[J]. Leukemia, 2019, 33(9): 2227-2240. doi: 10.1038/s41375-019-0508-7
-

| 引用本文: | 王佳萍, 宋妮妮, 盛立霞, 等. 循环肿瘤DNA在弥漫大B细胞淋巴瘤中的临床应用研究[J]. 临床血液学杂志, 2022, 35(1): 29-34. doi: 10.13201/j.issn.1004-2806.2022.01.006 |
| Citation: | WANG Jiaping, SONG Nini, SHENG Lixia, et al. Clinical application of circulating tumor DNA in diffuse large B-cell lymphoma[J]. J Clin Hematol, 2022, 35(1): 29-34. doi: 10.13201/j.issn.1004-2806.2022.01.006 |
- Figure 1.
- Figure 2.
- Figure 3.
- Figure 4.



 下载:
下载: