The significance of lymphocyte subsets in graft for immune rejection and immune reconstruction in patients with allogeneic hematopoietic stem cell transplantation
-
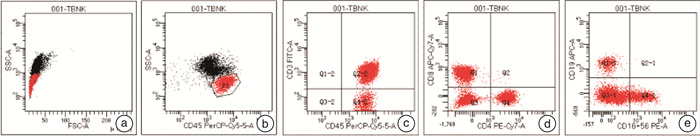
摘要: 目的 探讨供者干细胞采集物中淋巴细胞亚群分布对患者移植后移植物抗宿主病(GVHD)及免疫重建的临床意义。方法 该研究为前瞻性研究,纳入2020年1月—2021年9月西安交通大学第一附属医院血液内科收治的82例行异基因造血干细胞移植患者的供者干细胞采集物,应用流式细胞仪进行淋巴细胞亚群检测,包括CD4+T细胞、CD8+T细胞、B细胞以及NK细胞的比例。以各亚群细胞比例的中位值为界限,分为≥中位值组和 < 中位值组,分析淋巴细胞亚群比例不同的干细胞移植受者发生GVHD的概率以及淋巴细胞恢复的差异。结果 与 < 中位值组比较,供者干细胞中CD4+T细胞≥中位值组患者在移植后发生GVHD的概率更高(P < 0.05);CD8+T细胞≥中位值组患者移植后淋巴细胞恢复情况明显优于 < 中位值组(P < 0.05)。2组B细胞、NK细胞在GVHD发生率及患者淋巴细胞恢复情况中,差异无统计学意义。结论 供者干细胞采集物中CD4+T细胞比例高的患者移植后GVHD发生率高,而CD8+T细胞比例高的患者移植后淋巴细胞的重建优于比例低者,可通过干细胞淋巴细胞亚群检测预判受者GVHD发生率以及移植后淋巴细胞恢复情况。Abstract: Objective To study the clinical significance of lymphocyte subsets in graft for the incidence of graft-versus-host disease(GVHD) and immune reconstruction in patients with allogeneic hematopoietic stem cell transplantation(allo-HSCT).Methods Eighty-two patients with allo-HSCT have been included from patients hospitalized at the First Affiliated Hospital of Xi'an Jiaotong University between January 2020 and September 2021 were analyzed prospectively. Lymphocyte subsets in graft, including CD4+T cells, CD8+T cells, B cells and NK cells were detected by flow cytometry. Based on the median proportion, all patients were divided into the higher-proportion group(≥median proportion) and lower-proportion(< median proportion). The relationship between proportion of lymphocyte subsets in graft and the incidence of GVHD and immune reestablishment after transplantation were analyzed.Results The incidence of acute GVHD was higher in the higher-proportion group than that in the lower-proportion of CD4+T lymphocytes in graft(P < 0.05). While the immune reestablishment was better in the higher-proportion group of CD8+T lymphocytes than that in the lower-proportion(P < 0.05). There were no significant differences between higher-proportion and lower-proportion groups of B cells and NK cells in the incidence of GVHD and immune reestablishment.Conclusion Patients with higher proportion of CD4+T lymphocytes in graft higher incidence of GVHD, and patients with higher proportion of CD8+T lymphocytes in graft have better immune reestablishment. The lymphocyte subsets analysis in graft may help predict the incidence of GVHD and immune reconstruction in patients after allo-HSCT.
-
Key words:
- stem cells /
- lymphocyte subsets /
- graft-versus-host disease /
- immune reconstruction
-

-
表 1 GVHD+与GVHD-组患者基线特征
临床特征 GVHD+组(n=42) GVHD-组(n=40) P 性别/例(%) 0.697 男 29(69.0) 26(65.0) 女 13(31.0) 14(35.0) 年龄/岁 30.45±15.52 32.50±16.49 0.564 疾病分类/例(%) 0.965 急性髓系白血病 24(57.1) 23(57.5) 急性淋巴细胞白血病 10(23.8) 8(20.0) 再生障碍性贫血 6(14.3) 7(17.5) 非霍奇金淋巴瘤 2(4.8) 2(5.0) 表 2 2组患者移植后发生GVHD的情况
例(%) 干细胞采集物淋巴细胞数据 GVHD+组(n=42) GVHD-组(n=40) P 淋巴细胞 0.188 < 中位值(n=39) 17(43.6) 22(56.4) ≥中位值(n=43) 25(58.1) 18(41.9) CD3+CD4+T细胞 0.028 < 中位值(n=39) 15(38.5) 24(61.5) ≥中位值(n=43) 27(62.8) 16(37.2) CD3+CD8+T细胞 0.691 < 中位值(n=51) 27(52.9) 24(47.1) ≥中位值(n=31) 15(48.4) 16(51.6) B细胞 0.702 < 中位值(n=19) 9(47.4) 10(52.6) ≥中位值(n=63) 33(52.4) 30(47.6) NK细胞 0.702 < 中位值(n=63) 33(52.4) 30(47.6) ≥中位值(n=19) 9(47.4) 10(52.6) 表 3 恶性血液病患者allo-HSCT后中性粒细胞重建时淋巴细胞恢复情况
M(P25~P75) 干细胞采集物淋巴细胞数据 移植后淋巴细胞/ (×109·L-1) P 淋巴细胞 0.829 < 中位值(n=39) 3.60(1.93~11.65) ≥中位值(n=43) 4.50(1.90~10.10) CD3+CD4+T细胞 0.172 < 中位值(n=39) 5.70(2.93~9.78) ≥中位值(n=43) 2.70(1.68~12.83) CD3+CD8+T细胞 0.035 < 中位值(n=51) 3.45(1.93~7.25) ≥中位值(n=31) 5.70(2.40~15.00) B细胞 0.957 < 中位值(n=19) 4.10(2.05~10.05) ≥中位值(n=63) 4.20(1.88~12.40) NK细胞 0.517 < 中位值(n=63) 5.45(2.00~11.35) ≥中位值(n=19) 3.00(1.60~14.30) 表 4 恶性血液病患者allo-HSCT后15 d、30 d淋巴细胞亚群恢复情况
X±S 检测时间 CD3+T细胞/ (×109·L-1) CD3+CD4+T细胞/ (×109·L-1) CD3+CD8+T细胞/ (×109·L-1) B细胞/ (×109·L-1) NK细胞/ (×109·L-1) 移植后15 d 88.13±10.35 17.02±7.40 61.07±7.91 1.15±1.94 10.68±9.00 移植后30 d 82.82±7.67 18.20±8.42 55.22±6.35 1.00±0.97 12.90±8.24 -
[1] 赵潇溟, 黄爱杰, 胡晓霞, 等. 恶性血液病患者异基因造血干细胞移植后骨髓T淋巴细胞亚群重建的动态观察[J]. 第二军医大学学报, 2019, 40(12): 1285-1291. https://www.cnki.com.cn/Article/CJFDTOTAL-DEJD201912001.htm
[2] Ogonek J, Kralj JM, Ghimire S, et al. Immune Reconstitution after Allogeneic Hematopoietic Stem Cell Transplantation[J]. Front Immunol, 2016, 7: 507.
[3] 刘晓亮, 高素君, 赵杨祉, 等. 恶性血液病患者异基因造血干细胞移植后免疫细胞的重建[J]. 中华器官移植杂志, 2017, 38(2): 70-77.
[4] Vardiman JW. The World Health Organization(WHO) classification of tumors of the hematopoietic and lymphoid tissues: an overview with emphasis on the myeloid neoplasms[J]. Chem Biol Interact, 2010, 184(1-2): 16-20. doi: 10.1016/j.cbi.2009.10.009
[5] 石远凯, 孙燕, 刘彤华. 中国恶性淋巴瘤诊疗规范(2015年版)[J]. 中华肿瘤杂志, 2015, (2): 148-158. doi: 10.3760/cma.j.issn.0253-3766.2015.02.014
[6] 徐郑丽, 赵翔宇. 造血干细胞移植中KIR及其配体影响移植预后的研究进展[J]. 临床血液学杂志, 2021, 34(1): 71-75. https://www.cnki.com.cn/Article/CJFDTOTAL-LCXZ202101017.htm
[7] Signori A, Crocchiolo R, Oneto R, et al. Chronic graft-versus-host disease is associated with inferior relapse risk irrespective of stem cell source among patients receiving transplantation from unrelated donors[J]. Bone Marrow Transplant, 2012, 47(11): 1474-1478. doi: 10.1038/bmt.2012.58
[8] Bergot AS, Buckle I, Cikaluru S, et al. Regulatory T Cells Induced by Single-Peptide Liposome Immunotherapy Suppress Islet-Specific T Cell Responses to Multiple Antigens and Protect from Autoimmune Diabetes[J]. J Immunol, 2020, 204(7): 1787-1797. doi: 10.4049/jimmunol.1901128
[9] Xu H, Lauer FT, Liu KJ, et al. Environmentally relevant concentrations of arsenite and monomethylarsonous acid inhibit IL-7/STAT5 cytokine signaling pathways in mouse CD3+CD4-CD8-double negative thymus cells[J]. Toxicol Lett, 2016, 247: 62-68. doi: 10.1016/j.toxlet.2016.02.014
[10] Amezquita RA, Kaech SM. Immunology: The chronicles of T-cell exhaustion[J]. Nature, 2017, 543(7644): 190-191. doi: 10.1038/nature21508
[11] Li N, Matte-Martone C, Zheng H, et al. Memory T cells from minor histocompatibility antigen-vaccinated and virus-immune donors improve GVL and immune reconstitution[J]. Blood, 2011, 118(22): 5965-5976. doi: 10.1182/blood-2011-07-367011
[12] Dossa RG, Cunningham T, Sommermeyer D, et al. Development of T-cell immunotherapy for hematopoietic stem cell transplantation recipients at risk of leukemia relapse[J]. Blood, 2018, 131(1): 108-120. doi: 10.1182/blood-2017-07-791608
[13] 袁晓燕, 葛丽娜, 赵家兴, 等. 传染性单核细胞增多症患者外周血T细胞亚群检测及临床意义[J]. 中国微生态学杂志, 2021, 33(6): 679-682. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGWS202106012.htm
[14] Strober S, Cheng L, Zeng D, et al. Double negative(CD4-CD8-alpha beta+)T cells which promote tolerance induction and regulate autoimmunity[J]. Immunol Rev, 1996, 149: 217-230. doi: 10.1111/j.1600-065X.1996.tb00906.x
[15] 王新梅, 王雪野, 韩梅, 等. 人体外周血CD3+CD4-CD8-双阴性T细胞体外扩增的实验研究[J]. 中国实验诊断学, 2017, 21(10): 1831-1834. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSZD201710056.htm
[16] Mackall CL, Granger L, Sheard MA, et al. T-cell regeneration after bone marrow transplantation: differential CD45 isoform expression on thymic-derived versus thymic-independent progeny[J]. Blood, 1993, 82(8): 2585-2594.
[17] 王乾英, 张玉明. 异基因造血干细胞移植后T淋巴细胞免疫重建研究进展[J]. 中国小儿血液与肿瘤杂志, 2019, 24(2): 100-104, 108. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGXY201902009.htm
[18] Davoodzadeh GM, Kardar GA, Saeedi Y, et al. Exhaustion of T lymphocytes in the tumor microenvironment: Significance and effective mechanisms[J]. Cell Immunol, 2017, 322: 1-14.
[19] Carvalho A, Luca AD, Bozza S, et al. TLR3 essentially promotes protective class I-restricted memory CD8 T-cell responses to Aspergillus fumigatus in hematopoietic transplanted patients[J]. Blood, 2012, 119(4): 967-977.
-




 下载:
下载: