Value of cytometry microsphere array technology in differential diagnosis of infection status and types in patients with multiple myeloma
-
摘要: 目的 探析流式微球阵列技术(cytometric bead array,CBA)鉴别诊断多发性骨髓瘤(multiple myeloma,MM)患者感染状态及类型的价值。方法 采用回顾性队列研究方法,收集2019年1月—2022年12月医院收治的214例MM患者临床资料,按照是否感染分为MM合并感染患者作为观察组(110例),MM未感染患者作为对照组(104例)。110例感染观察组中,49例为革兰阳性菌感染(G+菌感染组),48例为革兰阴性菌感染(G-菌感染组),13例为真菌感染。所有样本采用CBA检测技术检测Th1/Th2细胞因子谱。比较辅助性T细胞(Th)1/Th2细胞因子谱、C-反应蛋白(CRP)和降钙素原(PCT)水平,观察MM患者未感染及感染状态下Th1/Th2细胞因子谱特征,分析CBA检测技术检测Th1/Th2细胞因子谱评估MM患者感染的价值。结果 观察组肿瘤坏死因子-α(TNF-α)、干扰素(IFN)-γ、白细胞介素(IL)-6、IL-10、CRP和PCT水平均高于对照组,差异有统计学意义(P<0.05);2组IL-2、IL-4水平比较,差异无统计学意义(P>0.05)。G-菌感染组IL-6、IL-10、CRP和PCT水平高于G+菌感染组和真菌感染组,且G+菌感染组IL-6、CRP水平高于真菌感染组,PCT水平低于真菌感染组,差异有统计学意义(P<0.05);感染的3组中IL-2、TNF-α、IFN-γ和IL-4水平比较,差异无统计学意义(P>0.05)。绘制受试者工作特征曲线(ROC)显示,TNF-α、IFN-γ、IL-6、IL-10、CRP和PCT对MM患者感染情况的评估价值均良好,且以IL-6和IL-10的评估价值最为显著;IL-6、IL-10、CRP和PCT评估不同感染类型的MM合并感染患者的价值均良好。结论 相比于传统CRP、PCT等传统指标,CBA技术检测Th1/Th2细胞因子谱对于MM患者早期感染的快速诊断、严重程度评估有重要价值,以TNF-α、IFN-γ、IL-6、IL-10水平均明显升高为特征,且有助于进一步辅助鉴别G+菌和G-菌感染类型。Abstract: Objective To explore the value of cytometric bead array(CBA) in differential diagnosis of infection status and types in patients with multiple myeloma(MM).Methods A retrospective cohort study was used to collect the clinical data of 214 patients with MM admitted to the hospital from January 2019 to December 2022. According to whether had infection these patients was divided into MM patients with infection as the observation group(110 cases), MM patients without infection as the control group(104 cases), of which 110 cases of infection in the observation group, 49 cases of Gram-positive bacteria infection(G+bacteria infection group), 48 cases of Gram-negative bacteria infection(G-bacteria infection group), 13 cases of fungal infection. All samples were tested for Th1/Th2 cytokine profiles using CBA detection technology. The characteristics of Th1/Th2 cytokine profile in uninfected and infected MM patients were observed, and the value of CBA detection of Th1/Th2 cytokine profile in evaluating infection in MM patients was analyzed.Results The levels of tumor necrosis factor-α(TNF-α), interferon(IFN) -γ, interleukin(IL) -6, IL-10, CRP and PCT in the observation group were higher than those in the control group, with a statistical significant difference(P<0.05). There was no statistical significant difference in the levels of IL-2 and IL-4 between the two groups(P>0.05). The levels of IL-6, IL-10, CRP and PCT in G- bacterial infection group were higher than those in G+bacterial infection group and fungal infection group, and the levels of IL-6 and CRP in G+bacterial infection group were higher than those in fungal infection group, and the level of PCT was lower than that in fungal infection group, with a statistical significant difference(P<0.05). There was no statistical significant difference in the levels of IL-2, TNF-α, IFN-γ, and IL-4 among the three groups(P>0.05). The receiver operating characteristic curve(ROC) was drawn and the results showed that TNF-α, IFN-γ, IL-6, IL-10, CRP, and PCT had good evaluation value for infection status in MM patients, with IL-6 and IL-10 being the most significant evaluation values. The value of IL-6, IL-10, CRP and PCT in evaluating MM patients with different infection types was good.Conclusion Compared with traditional indicators such as CRP and PCT, CBA technology for detecting Th1/Th2 cytokine profiles may be of great value for rapid diagnosis and severity assessment of early infection in the patients with MM, characterized by significantly elevated levels of TNF-α, IFN-γ, IL-6, and IL-10, and can further assist in identifying G+and G- bacterial infection types.
-
Key words:
- multiple myeloma /
- infection /
- cytometric bead array /
- Th1/Th2 cytokine profile /
- C-reactive protein /
- procalcitonin
-

-
表 1 2组基线资料比较
例 组别 性别
男/女年龄/岁 吸烟史
是/否饮酒史
是/否观察组(n=110) 60/50 56.47±6.81 21/89 15/95 对照组(n=104) 58/46 57.59±7.25 20/84 13/91 χ2/t 0.032 1.159 0.001 0.061 P 0.857 0.248 0.979 0.805 表 2 2组Th1/Th2细胞因子谱、CRP和PCT水平比较
pg/mL,X±S 组别 例数 IL-2 TNF-α IFN-γ IL-4 IL-6 IL-10 CRP PCT 观察组 110 1.23±0.67 7.86±1.94 12.84±3.72 1.91±0.50 452.45±104.73 517.39±110.82 4.42±1.27 4.20±0.71 对照组 104 1.08±0.76 5.55±1.79 8.80±2.17 1.85±0.43 198.02±82.89 213.45±91.61 3.55±0.67 3.61±0.70 t 1.534 9.033 9.773 0.924 19.761 21.800 6.309 6.070 P 0.126 <0.001 <0.001 0.357 <0.001 <0.001 <0.001 <0.001 表 3 不同感染类型的MM合并感染患者Th1/Th2细胞因子谱、CRP和PCT水平
pg/mL,X±S 组别 例数 IL-2 TNF-α IFN-γ IL--4 IL-6 IL-10 CRP PCT G+菌感染组 49 1.25±0.60 8.03±1.89 12.94±3.74 1.95±0.55 431.22±93.42 494.53±86.22 3.45±0.65 4.04±0.74 G-菌感染组 48 1.26±0.73 7.88±1.78 12.71±3.80 1.95±0.47 497.25±93.92 559.32±118.02 3.81±0.60 4.38±0.73 真菌感染组 13 1.05±0.69 7.15±2.62 12.94±3.59 1.63±0.32 367.05±111.39 448.76±113.99 2.93±0.49 4.10±0.29 F 0.556 1.055 0.051 2.316 11.614 7.846 11.652 3.106 P 0.575 0.352 0.950 0.104 <0.001 <0.001 <0.001 0.049 表 4 各细胞因子评估MM合并感染患者的价值
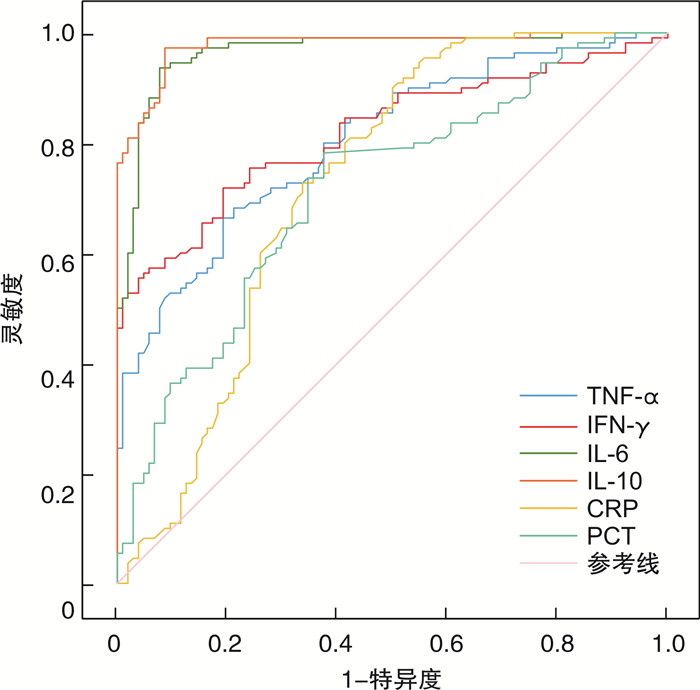
指标 AUC 95%CI SE P 截断值/(pg/mL) 特异度 灵敏度 约登指数 TNF-α 0.803 0.746~0.861 0.029 <0.001 7.050 0.808 0.664 0.472 IFN-γ 0.820 0.763~0.876 0.029 <0.001 10.520 0.808 0.718 0.526 IL-6 0.966 0.943~0.989 0.012 <0.001 313.100 0.923 0.936 0.859 IL-10 0.978 0.961~0.995 0.009 <0.001 329.095 0.913 0.973 0.886 CRP 0.725 0.655~0.796 0.036 <0.001 4.410 0.500 0.900 0.400 PCT 0.715 0.647~0.784 0.035 <0.001 3.615 0.625 0.782 0.407 表 5 细胞因子评估不同感染类型的MM合并感染患者的价值
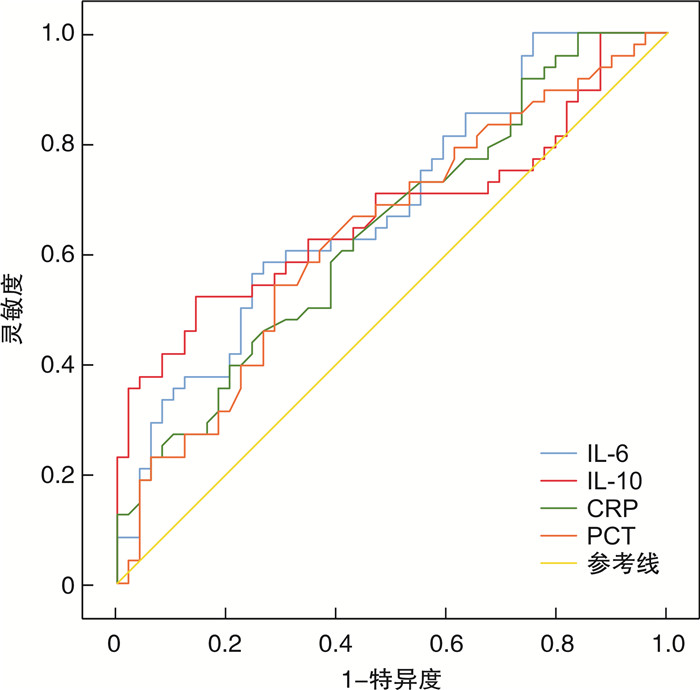
指标 AUC 95%CI SE P 截断值/(pg/mL) 特异度 灵敏度 约登指数 IL-6 0.683 0.578~0.788 0.054 0.002 483.340 0.735 0.583 0.318 IL-10 0.672 0.562~0.782 0.056 0.003 571.645 0.857 0.521 0.378 CRP 0.642 0.533~0.751 0.056 0.016 3.560 0.571 0.625 0.196 PCT 0.635 0.525~0.746 0.056 0.022 4.385 0.714 0.542 0.256 -
[1] Goldschmidt H. Klinisches update-multiples myelom[J]. Der Radiol, 2022, 62(1): 3-11. doi: 10.1007/s00117-021-00941-0
[2] von Bergwelt-Baildon M, Theurich S. Multiples myelom: bessere prognose dank rechtzeitigem beginn effektiver therapien[J]. Dtsch Med Wochenschr, 2020, 145(12): 799. doi: 10.1055/a-0952-9620
[3] Logue JM, Peres LC, Hashmi H, et al. Early cytopenias and infections after standard of care idecabtagene vicleucel in relapsed or refractory multiple myeloma[J]. Blood Adv, 2022, 6(24): 6109-6119. doi: 10.1182/bloodadvances.2022008320
[4] Knoll BM, Ahmed J, Karass M, et al. Procalcitonin as a biomarker to differentiate bacterial infections from engraftment syndrome following autologous hematopoietic stem cell transplantation for multiple myeloma[J]. American J Hematol, 2019, 94(3): E74-E76.
[5] 萧建华, 张海平. Th1/Th2细胞因子谱与PCT在急性白血病患儿感染中的诊断价值[J]. 中华医院感染学杂志, 2020, 30(10): 1564-1568.
[6] 中国医师协会血液科医师分会, 中华医学会血液学分会, 中国医师协会多发性骨髓瘤专业委员会. 中国多发性骨髓瘤诊治指南(2017年修订)[J]. 中华内科杂志, 2017, 56(11): 866-870. doi: 10.3760/cma.j.issn.0578-1426.2017.11.021
[7] 中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. doi: 10.3760/j:issn:0376-2491.2001.05.027
[8] Bongoni AK, Lanz J, Rieben R, et al. Development of a bead-based multiplex assay for the simultaneous detection of porcine inflammation markers using xMAP technology[J]. Cytometry Pt A, 2013, 83A(7): 636-647. doi: 10.1002/cyto.a.22287
[9] Soekojo CY, Low JZ, Oh J, et al. Bacterial infection among patients with multiple myeloma treated with bortezomib-based induction therapy: real-world experience in an Asian cancer center[J]. Clin Lymphoma Myeloma Leuk, 2020, 20(4): e165-e170. doi: 10.1016/j.clml.2019.12.024
[10] Bici A, Pianko MJ, Nachar VR. Incidence and risk factors for bacterial infection using bortezomib, lenalidomide, and dexamethasone(RVd)in newly diagnosed multiple myeloma[J]. Leuk Lymphoma, 2023, 64(2): 407-414. doi: 10.1080/10428194.2022.2138380
[11] Lim C, Sinha P, Harrison SJ, et al. Epidemiology and risks of infections in patients with multiple myeloma managed with new generation therapies[J]. Clin Lymphoma Myeloma Leuk, 2021, 21(7): 444-450.e3. doi: 10.1016/j.clml.2021.02.002
[12] 常鑫, 袁颖, 王明义. Th1/Th2与PCT检测在感染性疾病诊断中的临床应用[J]. 中国微生态学杂志, 2020, 32(4): 477-480.
[13] 申存存, 赵春慧, 邱净净, 等. 降钙素原、C反应蛋白及白细胞参数对新生儿败血症病情诊断的临床意义[J]. 临床血液学杂志, 2022, 35(4): 256-259. https://lcxy.whuhzzs.com/article/doi/10.13201/j.issn.1004-2806.2022.04.005
[14] 马宇杰, 侯卫坤, 许珂, 等. 宏基因组学第二代测序技术在骨感染诊断中的应用及发展[J]. 国际外科学杂志, 2022, 49(11): 780-784.
[15] 张慧秋, 刘丽, 刘玲, 等. 严重多发伤患者外周血Th1/Th2细胞因子水平变化及其对医院感染的预测价值分析[J]. 中国感染与化疗杂志, 2022, 22(4): 418-424.
[16] van der Galiën HT, Loeffen EAH, Miedema KGE, et al. Predictive value of PCT and IL-6 for bacterial infection in children with cancer and febrile neutropenia[J]. Support Care Cancer, 2018, 26(11): 3819-3826. doi: 10.1007/s00520-018-4249-3
[17] 杨李, 卢文婕, 张爱萍, 等. 白细胞CD64指数和白细胞介素-6在儿童急性白血病化疗后中性粒细胞缺乏伴发热诊疗中作用[J]. 中华实用诊断与治疗杂志, 2020, 34(12): 1274-1277.
[18] Guan JJ, Wang ZY, Liu XY, et al. IL-6 and IL-10 closely correlate with bacterial bloodstream infection[J]. Iran J Immunol, 2020, 17(3): 185-203.
[19] Li X, Xu S, Yu M, et al. Risk factors for severity and mortality in adult COVID-19 inpatients in Wuhan[J]. J Allergy Clin Immunol, 2020, 146(1): 110-118. doi: 10.1016/j.jaci.2020.04.006
[20] 解晶, 王翔, 张国彬, 等. 基于流式微球技术检测6种细胞因子在斑秃患者外周血中的表达及临床意义研究[J]. 中国卫生检验杂志, 2022, 32(6): 706-709, 712.
[21] 任会均, 马小涵, 彭若玉, 等. 血浆Th1/Th2细胞因子检测在血流感染诊断中的应用价值[J]. 郑州大学学报(医学版), 2021, 56(4): 539-544.
[22] 刘玉鑫, 韩迎香, 包爱玲, 等. 流式微球阵列法检测Th1/Th2细胞因子谱在细菌性血流感染中的临床应用[J]. 临床检验杂志, 2022, 40(11): 812-816.
[23] 胡珊博, 杨婧, 于超平, 等. IL-6、IL-1β和IL-10在外周血的水平可作为早期鉴别革兰阳性与革兰阴性脓毒症的指标[J]. 细胞与分子免疫学杂志, 2021, 37(6): 532-537.
-




 下载:
下载: